| Artigo Original, Biomed Biopharm Res., 2023; 20(2):58-73 doi: 10.19277/bbr.20.2.329; PDF Bilingue [+]; html em inglês [EN] |
Atividade antimicrobiana de nanopartículas preparadas com O-carboximetilquitosana: γ-Fe2O3:prata e extrato de Piper solmsianum
Francieli Molinett 1 ![]() , Clovis Antonio Rodrigues 1
, Clovis Antonio Rodrigues 1 ![]() , Gizelle Inácio Almerindo 1
, Gizelle Inácio Almerindo 1 ![]() , Rosi Zanoni da Silva 2
, Rosi Zanoni da Silva 2 ![]() , Jacir Dal Magro 3
, Jacir Dal Magro 3 ![]() , Rafael Martello 3
, Rafael Martello 3 ![]() , Anna Slawska-Waniewska 4
, Anna Slawska-Waniewska 4 ![]() , Natalia Nedelko 4
, Natalia Nedelko 4 ![]() , & Alexandre Bella Cruz 1
, & Alexandre Bella Cruz 1 ![]()
1 - Núcleo de Investigações Químico-Farmacêuticas (NIQFAR), Universidade do Vale do Itajaí (UNIVALI), Itajaí, SC, Brazil, 88.302-202. Fax +55 (47) 3341.7601
2 - Departamento de Ciências Farmacêuticas, Universidade Estadual de Ponta Grossa (UEPG), Av. Carlos Cavalcanti, 4748, Uvaranas, Ponta Grossa, PR, Brazil, 84.030-900
3 - Programa de Pós-Graduação em Ciências Ambientais, Universidade Comunitária da Região de Chapecó (UNOCHAPECÓ), Servidão Anjo da Guarda, 295-D, Bairro Efapi, Chapecó, SC, Brazil, 89.809-900
4 - Institute of Physics, Polish Academy of Sciences, Aleja Lotników 32/46 PL–02668, Warsaw, Poland
Resumo
Nanopartículas de prata incorporadas a nanocompósitos magnéticos foram sintetizadas com extrato metanólico bruto de Piper solmsianum, que foi utilizado como agente de redução e estabilização em nanomaterial sintético assistido por fitoquímicos. A atividade antimicrobiana sobre micro-organismos patogênicos foi descrita. As nanopartículas sintetizadas também foram caracterizadas por microscopia eletrônica de transmissão e análise de quantificação de Ag. A atividade antimicrobiana foi avaliada pelo método de microdiluição em caldo, sobre as bactérias Bacillus subtilis, Staphylococcus aureus e Escherichia coli, e a levedura Candida albicans. Dentre os nove compostos testados, CMAgPs2 e CMAgPs5 foram os que apresentaram os melhores resultados em termos de atividade contra bactérias (bactericidas) e leveduras (fungistáticos). Observou-se que o extrato metanólico bruto demonstrou ser um potencial agente redutor para a síntese verde. Também foi verificado que nenhuma amostra de CMAgPs foi tóxica no teste de Artemia salina.
Palavras-chave: Nanopartícula de prata, magnética, Piper, antimicrobiano, carboximetilquitosano
Para Citar: Molinett, F., et al. (2023) Antimicrobial activity of nanoparticles prepared with O-carboxymethylchitosan:γ-Fe2O3:silver and extract of Piper solmsianum. Biomedical and Biopharmaceutical Research, 20(2), 58-73.
Correspondência autor:
Recebido: 16/11/2023; Aceite: 31/12/2023
Introdução
Nanopartículas de prata (NPs) são amplamente utilizadas em nanotecnologia. Devido às suas propriedades físico-químicas especiais, as NPs de prata são frequentemente aplicadas em diversas áreas, incluindo medicina, saúde, agricultura, embalagens e eletrônica. Um dos principais problemas no uso de NPs em reações químicas está relacionado à aglomeração de NPs. A imobilização de NPs à suportes sólidos, como polímeros (1), materiais carbonáceos (2) e óxido metálico (3), evita a aglomeração de NPs durante reações químicas.
O uso de plantas ou extratos vegetais na síntese verde de nanopartículas de prata tem vantagens sobre outros recursos biológicos porque as plantas são facilmente encontradas. Diferentes partes das plantas foram utilizadas para fins de síntese, como folhas, raízes, frutos, caules, cascas e sementes. Diferentes extratos, como extratos aquosos, metanólicos, hidroalcoólicos e etanólicos, são os mais utilizados para esse fim (4). A presença de metabólitos secundários nas plantas e, consequentemente, em extratos, como terpenoides, flavonoides e alcaloides, leva à redução e cobertura (capeamento) de nanopartículas (5-9).
Segundo a Organização Mundial da Saúde, cerca de 2 bilhões de pessoas no mundo utilizam água de fontes contaminadas com fezes, que podem transmitir doenças como diarreia, cólera, disenteria, febre tifoide e poliomielite. Além disso, 844 milhões de pessoas não têm acesso à água potável (10). Portanto, tecnologias para o tratamento de água são necessárias e urgentes, especialmente tecnologias para desinfecção de ponto de uso (PDU) que são adequadas para situações onde os recursos são limitados. Como tal, as tecnologias de tratamento de água como PDU, têm recebido ampla atenção em todo o mundo (11).
Nanopartículas magnéticas (MNPs) são classes de nanopartículas que geralmente contêm o ferro (Fe0, Fe3O4, γ-Fe2O3). Devido às suas propriedades magnéticas, as partículas podem ser facilmente separadas do meio de processamento pela aplicação de um campo magnético externo. Os MNPs têm ampla aplicação em diversas áreas, mas principalmente naquelas relacionadas ao meio ambiente (12).
Nesse aspecto, quando preparadas ou incorporadas a substâncias com propriedades antimicrobianas ou adsorventes, as MNPs podem ser empregadas para a purificação de água em sistemas de PDU.
Piper solmsianum C. DC. (sin. Piper leucanthum ou Piper santosanum), popularmente conhecida no Brasil como caapeba ou pariparoba, é um arbusto frequentemente encontrado em áreas com solos tropicais úmidos. Mede entre 1 e 3 m de altura e apresenta ramos glabros e estriados. Suas folhas são pecioladas e o limbo é ovalado com ápice acuminado e truncado em base cordada. Apresenta flores hermafroditas representadas por inflorescências em espigas (13-15).
Estudos fitoquímicos da planta indicaram a presença de hidrocarbonetos alifáticos, monoterpenos, sesquiterpenos, arilpropanoides, neolignanas (15-17) e flavonoides (18). Tem sido relatado que a planta possui ação antibacteriana (19), antituberculose (20), antifúngica (18) e tripanomicida (21).
No presente estudo in vitro, focamos nas propriedades antimicrobianas de O-carboximethychitosan/γ-Fe2O3/Ag0/Extrato de P. solmsianum (CMAgPs). Primeiramente, as nanopartículas foram sintetizadas e caracterizadas. Em seguida, as propriedades antimicrobianas dos CMAgPs foram testadas sobre os micro-organismos (Staphylococcus aureus, Escherichia coli, Candida albicans, Bacillus subtilis). Também foram avaliados os efeitos desta nanopartícula sobre o microcrustáceo vivo Artemia salina.
Materiais e métodos
Materiais
As nanopartículas O-carboximetilquitosana/γ-Fe2O3 (CM) e γ-Fe2O3 (MNP) foram sintetizadas e caracterizadas (1). Os ovos de Artemia salina (alta eclosão) foram adquiridos da Maramar Aquacultura Com. Imp. Exp. Ltda (Rio de Janeiro, Brasil). Os reagentes utilizados foram de grau analítico, adquiridos da Vetec (São Paulo, Brasil).
Para a avaliação antimicrobiana, foram utilizadas cepas da American Type Culture Collection (ATCC), Rockville, MD, EUA. As bacterias Bacillus subtilis (ATCC 23858), Staphylococcus aureus (ATCC 6538P), Escherichia coli (ATCC 25922) e a levedura Candida albicans (ATCC 10231).
Preparação do Extrato
Folhas de P. solmsianum C.D.C. var solmsianum (Piperaceae) foram coletadas em maio de 2016 em Ponta Grossa, PR, Brasil, e identificadas pela Dra. Elsie Franklin Guimarães. Um espécime foi depositado no Museu Botânico do Rio de Janeiro (RB 368597).
As folhas fragmentadas foram submetidas à extração com metanol (MeOH) à temperatura ambiente durante um período de 7 dias. O extrato MeOH foi concentrado através de evaporação sob pressão reduzida com um evaporador rotativo a 50 ºC para obter o extrato metanólico bruto (CE).
Síntese de nanocompósito de prata
O CM (0,750 g) foi disperso em 50 mL de água destilada. O AgNO3 (0,085; 0,340 e 0,68 g) foi solubilizado separadamente, adicionado à mistura e agitado por 20 min. Em seguida, (0,1; 0,2 e 0,3 g) de CE, dissolvido em 20 mL de uma solução metanol/etanol (40:10) foi adicionado à mistura. Hidróxido de amônio concentrado (0,06 mL) também foi adicionado e o pH foi ajustado para 11,0 com solução de hidróxido de sódio concentrado. A mistura foi agitada por 120 min, protegida da luz e aquecida a 80 ºC. Por fim, a mistura foi lavada com água destilada e seca sob vácuo por 24 horas. O composto resultante, O-carboximetilquitosana/γ-Fe2O3/Ag foi reduzido pelo extrato de P. solmsianum sendo denominado CMAgPs.
Caracterização do material
A morfologia da partícula foi avaliada sob microscopia eletrônica de transmissão (TEM) usando um microscópio eletrônico de transmissão (JEOL JEM-1011) operando a 100 kV no LCME/UFSC, Florianópolis, SC, Brasil. As amostras foram dispersas em álcool isopropílico e colocadas em ultrassonicador por 3 minutos. Em seguida, 10 μL foram adicionados em uma grade de cobre revestida com carbono e secados ao ar. As imagens foram analisadas por meio do programa de software ImageJ. A concentração de prata foi determinada por espectrofotometria de absorção atômica (AAnalystTM 800, PerkinElmer). A curva de calibração foi preparada por diluições seriadas da solução estoque 1000 mg L-1, utilizando padrões de verificação de graus de interferentes (SPEX CertiPrep®).
O teor de extrato de P. solmsianum presente no material foi determinado pela diferença de peso dos nanocompósitos após extração do material orgânico através de Soxhlet, utilizando metanol como solvente, por 24 horas.
Ensaio antimicrobiano
As concentrações inibitórias mínimas (CIM) contra cepas de bactérias e leveduras foram determinadas em placas de microtitulação de 96 poços por diluição dupla dos nanocompósitos usando uma microdiluição em caldo padrão dos agentes antibacterianos, seguindo as diretrizes do Clinical and Laboratory Standards Institute (22, 23), com pequenas modificações. Diluições seriadas do material antibacteriano foram realizadas em caldo Mueller-Hinton (bactéria) e Sabouraud dextrose (levedura), os quais foram inoculados com um número padronizado de organismos para obtenção da concentração celular final equivalente a 5 x 104 células mL-1 para bactérias e 0,5 x 103 a 5 x 103 células mL-1 para levedura, e incubados a 35 ºC por 18 horas (bactérias) e 24-48 horas (leveduras). As concentrações testadas variaram de 1000 a 1,95 µg mL-1. O crescimento celular foi determinado observando a turbidez da cultura. A menor concentração dos materiais em que nenhuma turbidez visual pode ser observada foi considerada a CIM dos materiais antimicrobianos.
Determinação da cinética de morte microbiana
A cinética de morte foi determinada pelo método proposto por CLSI (24), com adaptações. As amostras de CMAgPs com os menores valores de CIM para cada micro-organismo foram preparadas e adicionadas a um tubo de ensaio com 5 mL de Mueller-Hinton (bactéria) e Sabouraud (levedura). A seguir, foram adicionados 10 µL de inóculo a 0,5 x 108 células mL-1, padronizado por comparação com a escala de McFarland, e a solução foi homogeneizada. Para o controle positivo, foi adicionado apenas o inóculo. A solução com CMAgPs (500 µL) acrescida de inóculo, foram diluídas seriadamente (10-1 a 10-8) em solução salina (0,86%) estéril e o mesmo foi feito com o controle positivo (10-1 a 10-8). Em seguida, 50 µL de cada diluição foram dispersos em placas de Petri contendo ágar Mueller-Hinton e ágar Sabouraud, espalhadas na superfície da placa com auxílio de alça de Drigalski. Este procedimento foi repetido após 2, 4, 8 e 24 horas. Após cada procedimento, as placas foram incubadas a 35 ºC por 48 horas, e posteriormente as colônias foram contadas e para os cálculos, foi levado em consideração o fator de diluição, sendo os resultados relatados em unidades formadoras de colônias por mililitro (CFU mL-1) e então expresso em Log10.
Teste de exposição de Artemia salina a CMAgPs
Os testes foram realizados de acordo com o protocolo descrito e validado por Kos et al. (25). Os ovos desidratados de Artemia salina foram eclodidos em meio salino (sal marinho 38 g L-1) a pH 8,0. Os ovos foram dispersos no meio (100 mg de ovos por 100 mL de meio) e incubados por 24 h sob luz e aeração.
A toxicidade aguda foi determinada pela medição do número de Artemia mortas. Os náuplios com 24 horas de idade, foram transferidos para placas de 24 poços, com 10 náuplios cada, que foram colocadas em contato com os materiais e NPs (2 mL) nas concentrações de 5, 10, 15, 25, 50 e 100 mg L-1. Dez réplicas foram usadas para cada tratamento. Meio salino foi utilizado como controle negativo e solução de K2Cr2O7 60 mg L-1 como controle positivo. As placas foram incubadas no escuro a 24 °C. O número de náuplios mortos foi avaliado após 24 e 48 h, sendo os náuplios imóveis considerados mortos. O teste só foi considerado válido quando menos de 10% dos náuplios de controle estivessem imóveis.
A taxa de mortalidade foi calculada seguindo a equação:
Análise estatística
Para cada ensaio, as médias foram calculadas a partir das réplicas e as barras de erro corresponderam ao desvio padrão da média. Foi utilizada análise de variância de uma via (ANOVA de uma via), seguida pelo método de Dunnett e teste de Tukey, para determinar a significância estatística de cada parâmetro entre os tratamentos, com diferença significativa em p < 0,01 ou 0,05. As análises estatísticas foram realizadas por meio do software GraphPad Prism 5.0 (GraphPad Software).
Resultados e Discussões
Caracterização dos materiais
O CM foi previamente preparado e caracterizado. O mesmo apresentou magnetização de saturação, à temperatura ambiente, de 11,78 emu g-1 e a fração ponderal das partículas de γ-Fe2O3 foi estimada em ~18,6 % em peso (1).
Conteúdo de prata e extrato
Como o AgNO3 foi misturado com a solução de extrato vegetal, a cor inicial mudou de marrom para preto. Os metabólitos secundários presentes nas plantas, como fenóis, terpenoides, alcaloides, carboidratos e proteínas, que reduzem Ag+ a Ag0, desempenham um papel importante na síntese (26, 27). Os níveis relativamente elevados de eupomatenoide-3, eupomatenoide-5, conocarpano e orientina (18, 19), isoelemicina, siringaldeído, ácido 3,4,5-trimetoxi-benzóico, sitosterol, grandisina, rel-(7R,8R,70R,80R)-30,40-metilenodioxi-3,4,5,50-tetrametoxi-7,70-epoxilignan, rel-(7R,8R,70R,80R)-3,4,30,40-dimetilenodioxi-5,50-dimetoxi-7,70-epoxilignano (21); rel-(7R,8S,70S,80R)-3,4,5,30,40,50-hexametoxi-7,70-epoxilignan, rel-(7R,8S,70S,8R0)-30,40-metilenodioxi-3,4,5,50-tetrametoxi-7,70-epoxilignan (28), podem atuar como agentes redutores, ou agentes de cobertura (capeamento) que conferem estabilidade às nanopartículas de prata.
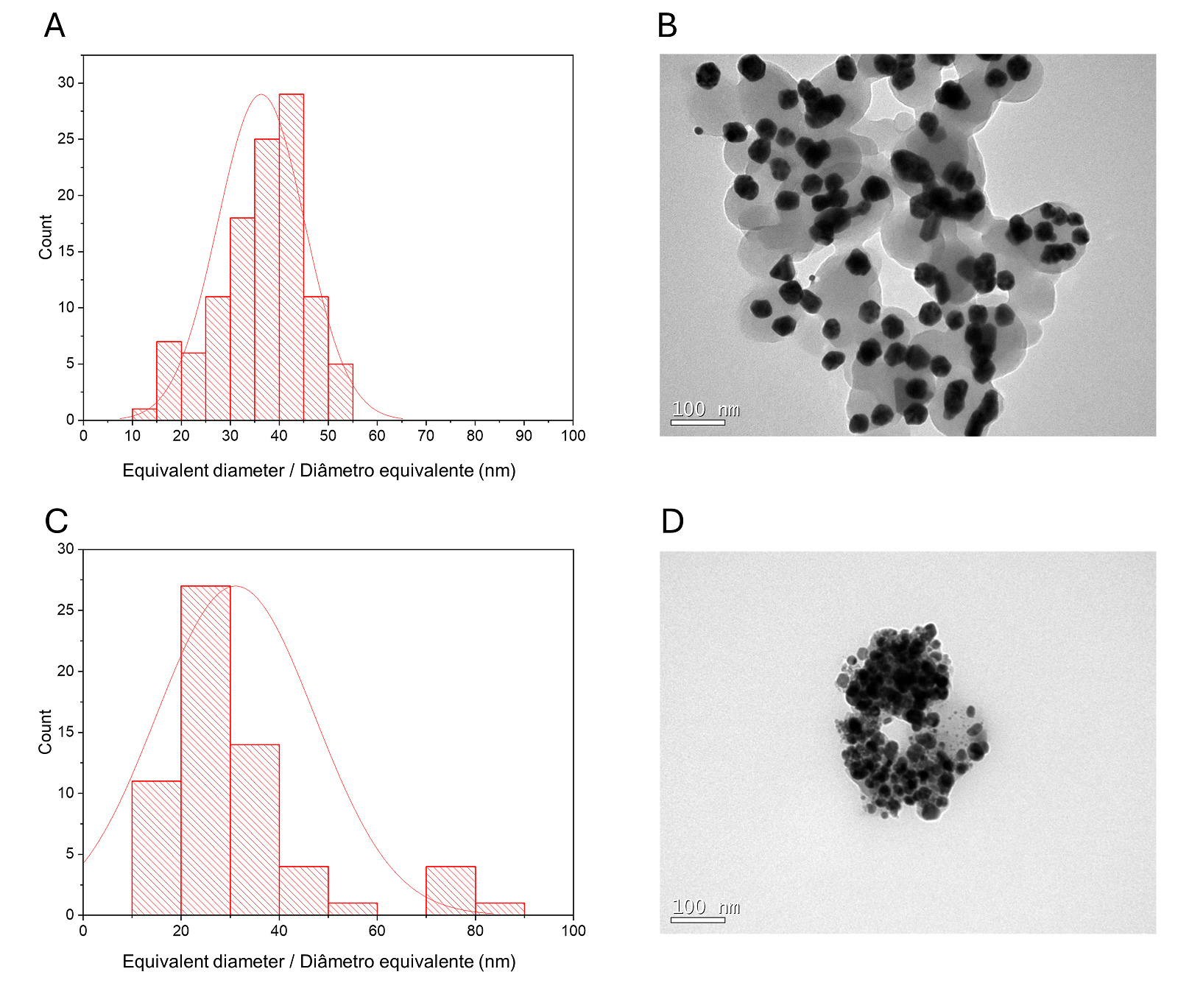
A quantidade de prata presente nos diferentes materiais é apresentada na Tabela 1. Os resultados mostram que a quantidade de prata incorporada no material magnético, aumenta com o aumento da quantidade de prata adicionada ao meio reacional. Quando a quantidade de prata adicionada foi pequena, a quantidade adicionada ao extrato não influênciou na quantidade de prata incorporada. Em meio alcalino, a presença de grupos amino livres de O-carboximetilquitosana e a temperatura de 80 ºC, fornecem condições para a formação de nanopartículas de prata (1). Os íons de prata inicialmente se difundiram no CM, então eles foram uniformemente ancorados na rede polimérica por muitos grupos –NH2, –COOH, –OH e –NHCOCH30 nas cadeias principais do CM, via coordenação e interações eletrostáticas e subsequente redução para Ag0. A fração quitosana presente na O-carboximetilquitosana (16%) pode atuar como agente redutor. No sistema de reação, o átomo de nitrogênio nas aminas pode perder um elétron para gerar sua forma oxidada, enquanto os íons de Ag+ podem receber o elétron para se tornar Ag0 (29).
| Tabela 1. Quantidade de prata e extrato de Piper solmsianum em oito diferentes nanocompósitos. |
 |
| * Extrato Metanólico Bruto; †Proporção CE: Ag (p:p). |
Por outro lado, à medida que aumentou a quantidade de prata adicionada ao meio, a quantidade de extrato adicionada influenciou diretamente na quantidade de prata incorporada. Nesses casos, a presença de fitoconstituintes com propriedades redutoras é fundamental para a redução de Ag+ a Ag0.
A quantidade de extrato incorporado ao material magnético variou entre 12,6-26,1% (Tabela 1). Quando os materiais foram preparados com 0,1 g de extrato, ocorreu a incorporação total do extrato. A solução de filtração resultante era incolor (dados não mostrados). Quando maiores concentrações foram utilizadas (0,2 e 0,3 g) a solução resultante apresentou coloração esverdeada, indicando a presença de extrato solúvel.
Caracterização estrutural TEM
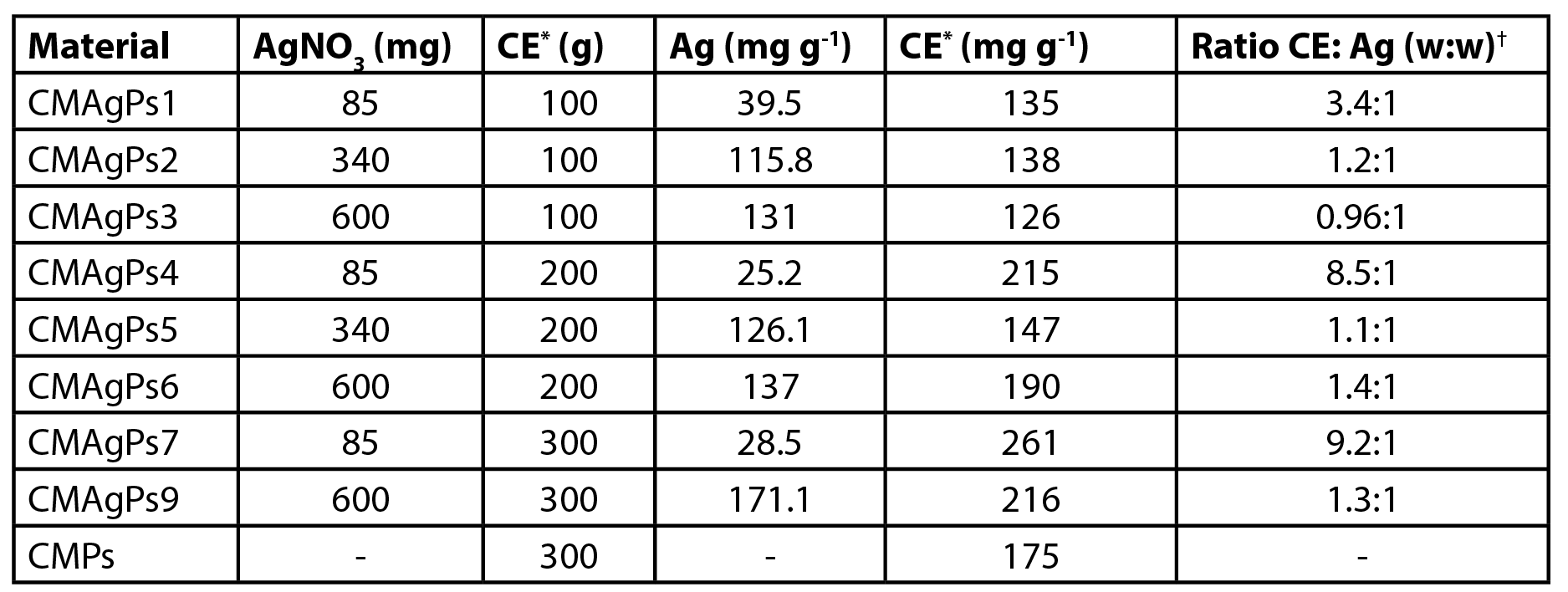
A morfologia detalhada e os estudos estruturais do nanocompósito O-carboximetilquitosana/γ-Fe2O3 (CM), descritos anteriormente, mostraram que as nanopartículas de γ-Fe2O3 têm um diâmetro médio de 9,2 nm (1). A imagem TEM dos CMAgPs preparados com partículas Ag e γ-Fe2O3 na matriz O-carboximetilquitosana/extrato é mostrada na Figura 1A.
Um histograma de tamanhos de partícula CMAgPs9 é mostrado na Figura 1B. Pode ser descrito satisfatoriamente por uma distribuição log normal de diâmetros de partícula, dando um tamanho médio de 28,1 + 9,7 nm, e com ampla distribuição de tamanho (10-60 nm). A quantidade de extrato presente nas partículas não alterou o tamanho das partículas (Figura 2). Os tamanhos de partícula encontrados foram maiores do que os relatados para os extratos de Eugenia umbelliflora, sacarose e NaBH4 (1) que foram usados como agente redutor de prata. O tamanho da partícula depende da quantidade de sal de prata, da quantidade e tipo de capeamento e do agente redutor (30, 31).
| Figura 1 - Imagem TEM do nanocompósito CMAgPs9 (A) e histograma de distribuição de tamanho de partícula (Ag e γ-Fe2O3) com função log-normal (linha preta sólida) obtida para partículas γ-Fe2O3 em CMAgPs9 (B). |
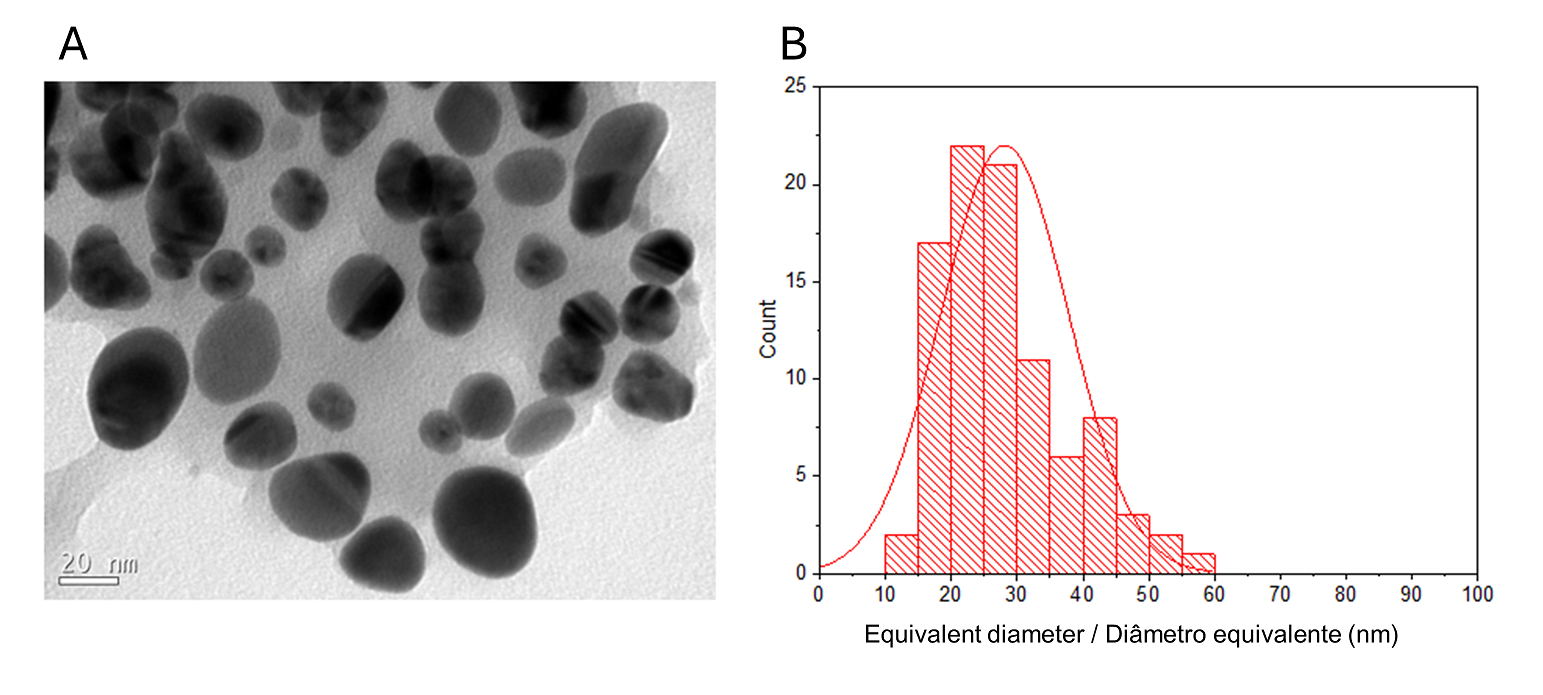 |
| Figura 2 - Histograma de distribuição do tamanho de partícula (Ag e γ-Fe2O3) com função log-normal (linha preta contínua) obtido para partículas de γ-Fe2O3 em CMAgPs5 (A) e imagem TEM do nanocompósito CMAgPs5 (B) e em CMAgPs1 (C) e imagem TEM do nanocompósito CMAgPs1 (D). |
 |
Actividade Antimicrobiana
A atividade antibacteriana dos materiais CMAgPs foi avaliada quantitativamente pela determinação da CIM contra os patógenos. Os resultados são mostrados na Tabela 2. Como pode ser visto, todas as NPs de prata apresentaram atividade contra todas as cepas de organismos testadas (bactérias e levedura), mas a atividade variou de acordo com as concentrações de prata e CE de P. solmsianum em cada amostra.
| Tabela 2 - Concentração inibitória mínima (CIM) de oito amostras de nanopartículas associadas a diferentes concentrações de extrato de Piper solmsianum. |
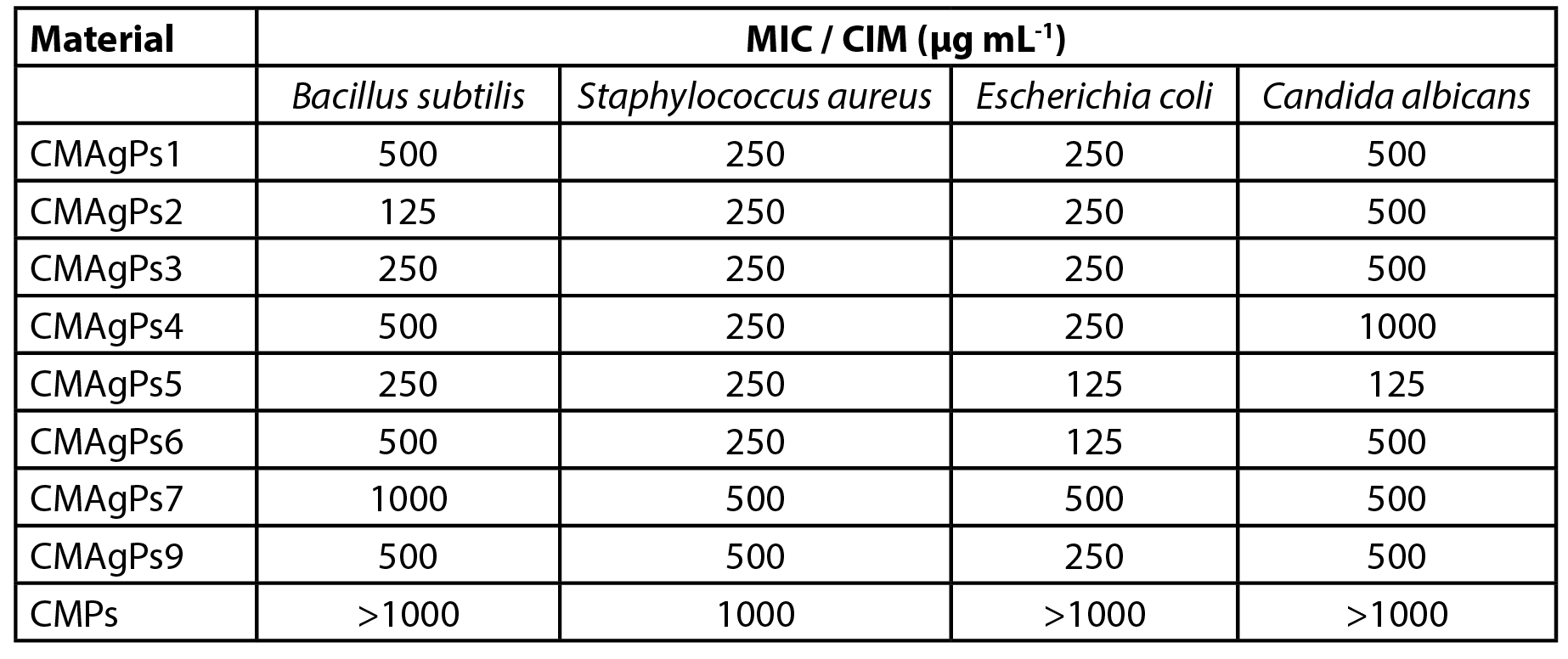 |
A concentração inibitória mínima das amostras variou de 125 a 1000 µg mL-1, e o organismo mais sensível foi a E. coli. Como pode ser observado, o aumento da quantidade de extrato empregado na complexação do CM com AgNO3 não potencializou o efeito antimicrobiano do extrato, mas sua adição atuou como agente redutor de prata.
A concentração do extrato de P. solmsianum no NP foi de 175 µg mL-1, o que foi suficiente para uma boa atividade antimicrobiana, pois é relatado que o CE tem atividade entre CIM entre 6 e 30 µg mL-1 para bactérias gram-positivas e CIM entre 20 e 30 µg mL-1 para fungos (18,19). No entanto, a NP livre de prata apresentou atividade fraca contra S. aureus, e inativa para os demais micro-organismos testados.
Os resultados da atividade antimicrobiana apresentados pelos CMAgPs NP sugerem que não houve relação entre a quantidade de prata e CE de P. solmsianum residual e a atividade antimicrobiana, uma vez que não variou proporcionalmente à quantidade de prata e CME presentes.
Não houve correlação entre a CIM das amostras de NP com as respectivas concentrações de CE e Ag. No entanto, quando a relação entre esses dois componentes nas amostras NP foi adicionada à análise, pode-se inferir que o NP com os melhores perfis de atividade (CMAgPs2, CMAgPs5 e CMAgPs6) foram aqueles em que as proporções de CE e Ag ficaram entre 1,1:1 e 1,4:1, sugerindo que maiores concentrações de CE podem estar atrapalhando a atividade cobrindo os sítios ativos do Ag. Os resultados também mostraram que baixas concentrações de Ag em NP não foram suficientes para uma boa atividade antimicrobiana.
Cinética de morte microbiana
Os ensaios de avaliação da cinética de morte foram realizados empregando-se a NP que apresentou o melhor perfil de inibição (CMAgPs5) contra E. coli e C. albicans. Para E. coli, as análises foram baseadas nas concentrações CIM (125 µg mL-1) e sub-inibitória (62,5 µg mL-1), para o qual os resultados revelaram que o NP (CMAgPs5) apresentou ação bactericida, onde após a primeiro hora, houve redução acentuada da viabilidade e após a quarta hora, a viabilidade celular, para a concentração de 125 µg mL-1, não foi mais observada. Além disso, como pode ser visto na Figura 3A, após 24 h, para ambas as concentrações de NP, houve uma redução na viabilidade da ordem de ≤ 6 Log10, em relação ao controle. Com base no resultado da concentração subinibitória, que ainda tem efeito bactericida, também foi avaliada uma concentração equivalente a ¼ da CIM (15,62 µg mL-1). Nesta concentração, o composto apresentou redução no número de células viáveis na ordem de ≤ 3 Log10 até a oitava hora de incubação, em relação ao controle, e após este tempo, houve aumento no número de células viáveis, mostrando que nesta concentração, a inibição ocorre, porém o micro-organismo permanece viável. Um estudo semelhante foi conduzido por Haque et al. (32) com NPAg, que também obteve resultados semelhantes contra E. coli. Portanto, considerando a concentração do princípio ativo sobre o micro-organismo, o tempo de inibição e a sua inviabilidade, os resultados encontrados para CMAgPs5 podem ser considerados bastante promissores.
Para C. albicans, a análise dos dados da cinética de morte revelou um efeito fungistático da NP sobre a levedura, pois reduziu a população viável (CFU mL-1) em ≤ 2 Log10, quando comparado ao controle (Figura 3B). No entanto, não foi capaz de inviabilizar completamente este organismo. Compostos com este tipo de ação apenas inibem o crescimento microbiano sem necessariamente inviabilizá-lo.
| Figura 3 - Curva de tempo de morte de Escherichia coli (A) e Candida albicans (B) submetidas à ação da nanopartícula CMAgPs5. |
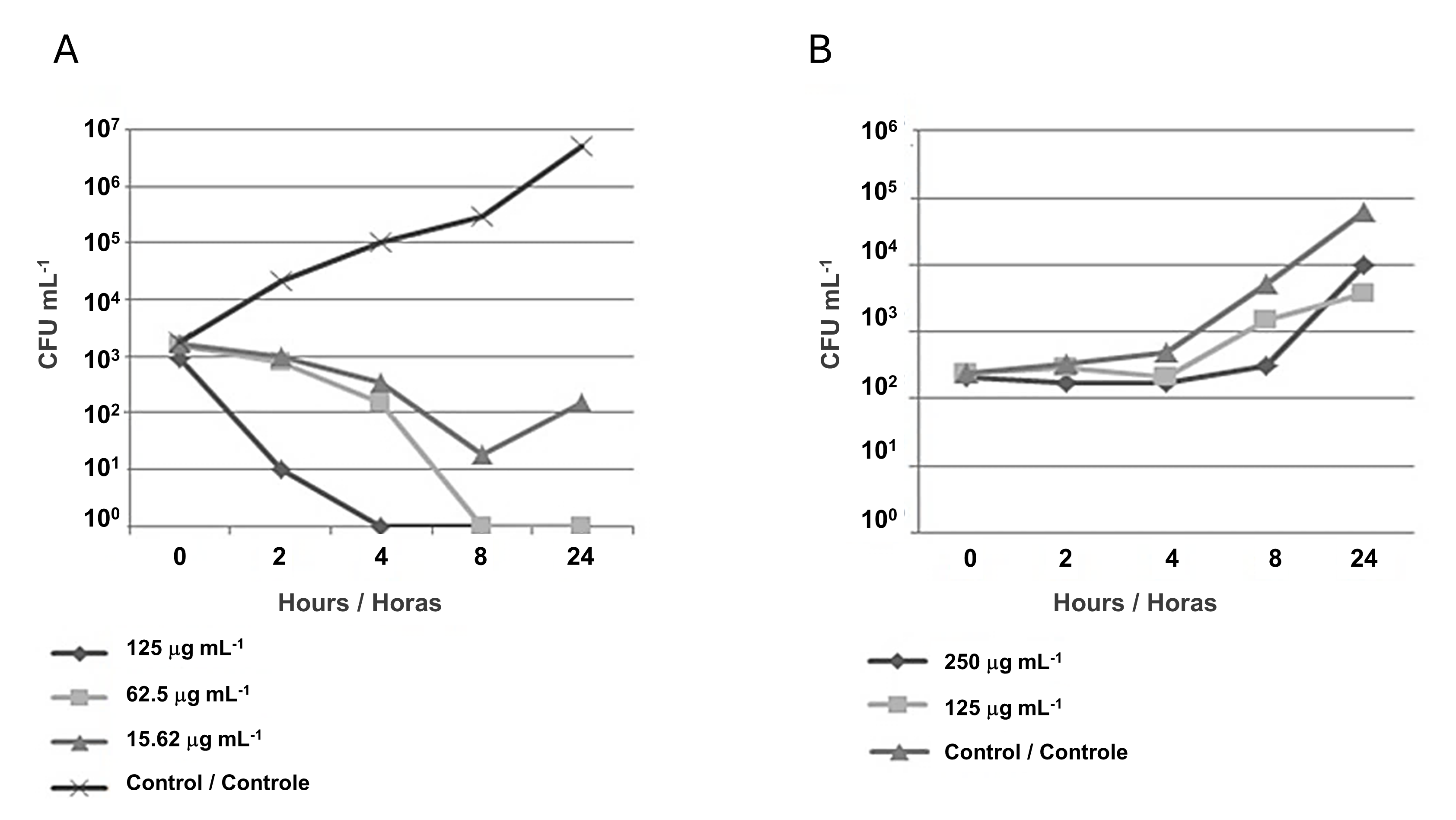 |
Em geral, o efeito fungistático é causado por algum dano metabólico reversível na levedura que pode voltar a crescer com o tempo. Neste experimento, para CMAgPs5, o crescimento ocorreu após 4 h. Com base nesses resultados, a concentração suprainibitória foi avaliada como duas vezes a CIM (250 µg mL-1). Observou-se que nesta dose, a levedura manteve o número de células viáveis estável por 8 h sem crescimento considerável, porém, após este período, o número de células viáveis aumentou para os níveis semelhantes ao controle. E após esse período, o número de viáveis aumentou, assim como o controle.
Toxicidade associada ao nanocompósito em náuplios de Artemia salina
A citotoxicidade sobre A. salina é um dos métodos de triagem e detecção de citotoxicidade para diversos produtos. Para este teste, os compostos com melhores resultados atividade antimicrobiana, bem como, àqueles pudessem cobrir desde as menores concentrações de Ag (CMPs e CMAgPs1) até as maiores (CMAgPs9), passando por uma concentração intermediária (CMAgPs5) e mesmo critério para a concentração de CE. Os respectivos resultados são mostrados na Tabela 3.
| Tabela 3 - Citotoxicidade de quatro nanocompósitos selecionados e do extrato de Piper solmsianum sobre Artemia salina. |
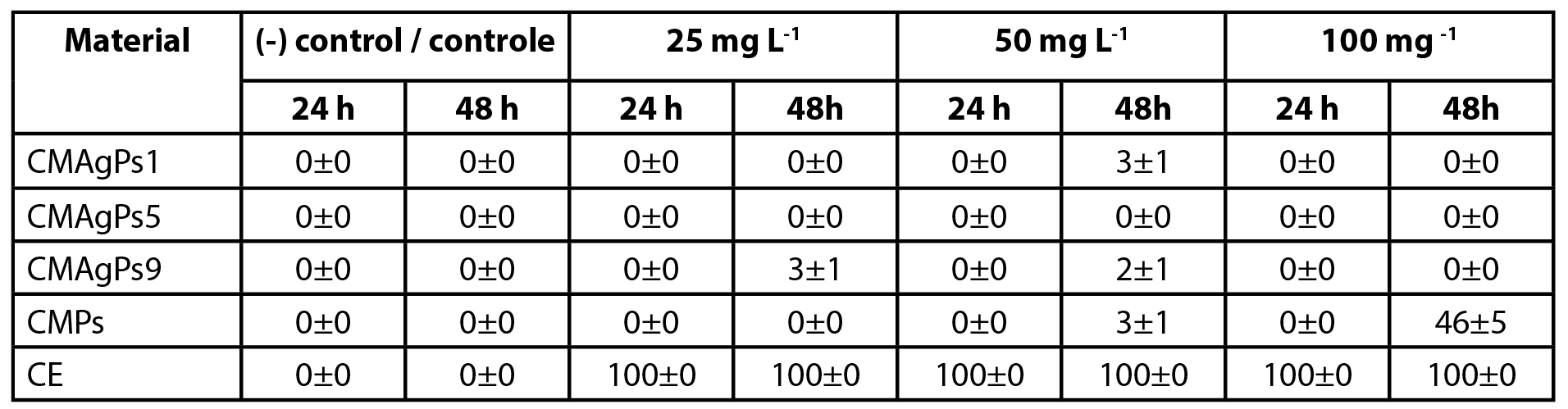 |
Nenhum náuplio morreu durante os testes de toxicidade no grupo controle. Após exposição por 24 h, nenhum efeito na sobrevivência dos náuplios foi observado para CMAgPs na faixa de concentração utilizada. Quando os náuplios estiveram em contato com o CE, 100% de morte foi observada em 24 h, em toda a faixa de concentração. Após exposição por 48 h, com os CMAgPs, 46% dos náuplios morreram na concentração de 100 mg L-1 e a morte de todos os náupliosfoi observado (p<0,001) para CE na faixa de concentração utilizada.
O EC50 do CE P. solmsianum para os náuplios tem sido relatado como 89,9 µg L-1 (18). Essa concentração está bem abaixo da apresentada no presente estudo, que ficou entre 3,4 e 26,6 mg L-1. Este resultado revela que a incorporação do extrato no material magnético diminui sua toxicidade, o que pode ser atribuído à diminuição da solubilidade do extrato incorporado ao material magnético. A toxicidade das CMPs e CE aos náuplios de A. salina pode estar ligada à atividade citotóxica do conocarpano, que possui IC50 de 2,9 µg L-1 (18), porém são necessários mais estudos para elucidar que tipos de interações estão ocorrendo para que a toxicidade esteja sendo reduzida. Ressalta-se que embora o número de pesquisas que utilizem o teste de A. salina tenha aumentado, devido a vários fatores, e tenha apresentado boa correlação de citotoxicidade (33), ele não substitui outros testes mais específicos e sensíveis (34).
Conclusões
Todas as nanopartículas de prata (NPs) obtidas apresentaram atividade antimicrobiana. Os melhores resultados para atividade antibacteriana foram obtidos com CMAgPs2 contra B. subtilis, enquanto que CMAgPs5 e CMAgPs6 contra E. coli (CIM 125 µg mL-1). As NPs de CMAgPs1 a CMAgPs6 apresentaram boa atividade antibacteriana contra S. aureus (CIM de 250 µg mL-1), e CM-AgPs5 também apresentou boa atividade sobre C. albicans (CIM 125 µg mL-1). A avaliação da cinética de morte revelou que CMAgPs5 apresentou efeitos bactericidas e fungistáticos. Apesar da reconhecida atividade do CE, não foi observado seu efeito potencializador da atividade antimicrobiana, mas provou ser um potencial agente redutor para a síntese verde. No teste de toxicidade contra Artemia salina, nenhuma das NPs (CMAgPs) se mostrou tóxica.
Contribuições dos autores
O manuscrito foi produzido através das contribuições de todos os autores. F. Molinet, C.A. Rodrigues e A. Bella Cruz, que projetaram e realizaram os experimentos e analisaram os resultados obtidos. Os outros autores também realizaram experimentos para este estudo. F. Molinett escreveu o manuscrito e todos os co-autores forneceram feedback construtivo sobre o manuscrito.
Financiamento
Este estudo foi parcialmente financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Código Financeiro 001 e pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico-Brasil (CNPq). Este trabalho foi parcialmente realizado em laboratório financiado pelo POIG.02.02.00-00-025/09.
Agradecimentos
Os autores gostariam de agradecer ao LCME-UFSC pelo apoio técnico durante o trabalho de microscopia eletrônica.
Conflito de interesses
Os autores declaram que não têm interesses financeiros concorrentes conhecidos ou relacionamentos pessoais que possam parecer influenciar o trabalho relatado neste artigo.
Referências
1. Demarchi, C.A., Bella Cruz, A., Ślawska-Waniewska, A., Nedelko, N., Dłużewski, P., Kaleta, A., Trzciński, J., Magro, J.D., Scapinello, J. & Rodrigues, C.A. (2018). Synthesis of Ag@Fe2O3 nanocomposite based on o-carboxymethylchitosan with antimicrobial activity. International journal of biological macromolecules, 107(Pt A), 42–51. https://doi.org/10.1016/j.ijbiomac.2017.08.147
2. Arivizhivendhan, V., Mahesh, M., Boopathy, R., Karthikeyan, S., Mary, R.R. & Sekaran, G. (2018). Functioned silver nanoparticle loaded activated carbon for the recovery of bioactive molecule from bacterial fermenter for its bactericidal activity. Applied Surface Science, 427, 813–824. https://doi.org/10.1016/j.apsusc.2017.08.128
3. Shahriary, M., Veisi, H., Hekmati, M. & Hemmati, S. (2018). In situ green synthesis of Ag nanoparticles on herbal tea extract (Stachys lavandulifolia) modified magnetic iron oxide nanoparticles as antibacterial agent and their 4-nitrophenol catalytic reduction activity. Materials science & engineering. C, Materials for biological applications, 90, 57–66. https://doi.org/10.1016/j.msec.2018.04.044
4. Ahmad, S., Munir, S., Zeb, N., Ullah, A., Khan, B., Ali, J., Bilal, M., Omer, M., Alamzeb, M., Salman, S.M. & Ali, S. (2019). Green nanotechnology: a review on green synthesis of silver nanoparticles — an ecofriendly approach. International journal of nanomedicine, 14, 5087–5107. https://doi.org/10.2147/IJN.S200254
5. Abdelghany, T.M., Al-Rajhi, A.M.H., Al Abboud, M.A., Alawlaqi, M.M., Magdah, A.G., Helmy, E.A.M. & Mabrouk, A.S. (2018). Recent advances in green synthesis of silver nanoparticles and their applications: About future directions. A review. BioNanoScience 8, 5–16. https://doi.org/10.1007/s12668-017-0413-3
6. Majeed, A., Ullah, W., Anwar, A.W., Shuaib, A., Ilyas, U., Khalid, P., Mustafa, G., Junaid, M., Faheem, B. & Ali, S. (2018). Cost-effective biosynthesis of silver nanoparticles using different organs of plants and their antimicrobial applications: A review. Materials Technology: Advanced Performance Materials, 33, 313-320. https://doi.org/10.1080/10667857.2015.1108065
7. Shahid, M., Zhou, Y., Cheng, X-W., Zar, M.S., Chen, G. & Tang, R-C. (2018). Ferulic acid promoted in-situ generation of AgNPs@silk as functional colorants. Journal of Cleaner Production, 176, 736-744. https://doi.org/10.1016/j.jclepro.2017.12.171
8. Veisi, H., Azizi, S. & Mohammadi, M. (2018). Green synthesis of the silver nanoparticles mediated by Thymbra spicata extract and its application as a heterogeneous and recyclable nanocatalyst for catalytic reduction of a variety of dyes in water. Journal of Cleaner Production, 170, 1536-1543. https://doi.org/10.1016/j.jclepro.2017.09.265
9. Rafique, M., Sadaf, I., Tahir, M.B., Rafique, M.S., Nabi, G., Iqbal, T. & Sughr, K. (2019). Novel and facile synthesis of silver nanoparticles using Albizia procera leaf extract for dye degradation and antibacterial applications. Materials science & engineering. C, Materials for biological applications, 99, 1313-1324. https://doi.org/10.1016/j.msec.2019.02.059
10. WHO - World Health Organization. (2022). Drinking-water. Retrieved June 30, 2023, from https://www.who.int/news-room/fact-sheets/detail/drinking-water
11. Fan, M., Gong, L., Huang, Y., Wang, D. & Gong, Z. (2018). Facile preparation of silver nanoparticle decorated chitosan cryogels for point-of-use water disinfection. Science of The Total Environment 613-614, 1317-1323. https://doi.org/10.1016/j.scitotenv.2017.09.256
12. Sahbaz, D.A., Yakar, A. & Gündüz, U. (2019). Magnetic Fe3O4-chitosan micro- and nanoparticles for wastewater treatment. Particulate Science and Technology 37, 728-736. https://doi.org/1080/02726351.2018.1438544
13. Guimarães, E.F. & Carvalho-Silva, M. (2012). Piperaceae, In: Wanderley, M.G.L., Martins, S.E., Romanini, R.P., Melhem, T.S., Shepherd, G.J., Giulietii, A.M., Pirani, J.R., Kirizawa, M., Melo, M.M.R.F., Cordeiro, I., Kinoshita, L.S. (Eds.), Flora fanerogâmica do estado de São Paulo, v. 7, Instituto de Botânica, São Paulo, pp 263–320.
14. Reitz, R. (2003). Piperaceae, In: Flora Ilustrada Catarinense. Herbário Barbosa Rodrigues, Itajaí, Brazil.
15. Moreira, D.L., Kaplan, M.A. & Guimarães, E.F. (1995). Constituintes químicos de Piper solmsianumDC. (Piperaceae). Revista Brasileira de Farmácia, 76, 106-109.
16. Martins, R.C., Latorre, L.R., Sartorelli, P. & Kato, M.J. (2000). Phenylpropanoids and tetrahydrofuran lignans from Piper solmsianum. Phytochemistry 55, 843-846. https://doi.org/10.1016/S0031-9422(00)00295-8
17. Moreira, D.L., Souza, P.O., Kaplan, M.A., Pereira, N.A., Cardoso, G.L. & Guimarães, E.F. (2001). Effect of leaf essential oil from Piper solmsianum C.DC. in mice behaviour. Anais da Academia Brasileira de Ciências, 73, 33-37. http://dx.doi.org/10.1590/S0001-37652001000100004
18. Campos, M.P., Chechinel Filho. V., Silva, R.Z., Yunes, R.A., Zacchino, S., Juarez, S., Cruz, R.C.B. & Bella Cruz, A. (2005). Evaluation of antifungal activity of Piper solmsianum DC. var. solmsianum (Piperaceae). Biological and Pharmaceutical Bulletin, 28, 1527-1530. https://doi.org/10.1248/bpb.28.1527
19. Campos, M.P., Chechinel Filho, V., Silva, R.Z., Yunes, R.A., Monache, F.D. & Bella Cruz, A. (2007). Antibacterial activity of extract, fractions and four compounds extracted from Piper solmsianum DC. var. solmsianum (Piperaceae). Zeitschrift für Naturforschung C., 62, 173-178. https://doi.org/10.1515/znc-2007-3-404
20. Lopes, M.A., Ferracioli, K.R.C., Siqueira, V.L.D., de Lima Scodro, R.B., Cortez, D.A.G., da Silva, R.Z. & Cardoso, R.F. (2014). In vitro interaction of eupomatenoid-5 from Piper solmsianum C. DC. var. solmsianum and anti-tuberculosis drugs. The International Journal of Tuberculosis and Lung Disease, 18, 1513-1515. https://doi.org/10.5588/ijtld.14.0229
21. Martins, R.C., Lago, J.H., Albuquerque, S. & Kato, M.J. (2003). Trypanocidal tetrahydrofuran lignans from inflorescences of Piper solmsianum. Phytochemistry 64, 667-670. https://doi.org/10.1016/s0031-9422(03)00356-x
22. CLSI (2015). Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically.Approved standard, 10th Document M07-A10, Clinical and Laboratory Standards Institute, Wayne, PA.
23. CLSI (2008). Method for broth dilution antifungal susceptibility testing of yeasts. Approved standard, 3th Document M27-A3. Clinical and Laboratory Standards Institute, Wayne, PA.
24. CLSI (1999). Methods for determining bactericidal activity of antimicrobial agents. Approved guideline, Document M26-A. Clinical Laboratory Standards Institute, Wayne, PA.
25. Kos, M., Kahru, A., Drobne, D., Singh, S., Kalčíková, G., Kühnel, D., Rohit, R., Gotvajn, A.Ž. & Jemec, A. (2016). A case study to optimise and validate the brine shrimp Artemia franciscana immobilisation assay with silver nanoparticles: The role of harmonisation, Environmental Pollution, 213, 173–183. https://doi.org/10.1016/j.envpol.2016.02.015
26. Sajjadi, G., Amini, J., Arani, A.S. & Nezammahalleh, H. (2018). Extracellular synthesis of silver nanoparticles using four fungal species isolated from lichens. IET Nanobiotechnology 12, 64-70. https://doi.org/1049/iet-nbt.2017.0170
27. Mazumder, J.A., Perwez, M., Noori, R. & Sardar, M. (2019). Development of sustainable and reusable silver nanoparticle-coated glass for the treatment of contaminated water. Environmental science and pollution research international, 26(22), 23070–23081. https://doi.org/10.1007/s11356-019-05647-4
28. Ramos, C.S., Linnert, H.V., Moraes, M.M., Amaral, J.H., Yamaguchi, L.F. & Kato, M.J. (2017). Configuration and stability of naturally occurring all-cis-tetrahydrofuran lignans from Piper solmsianum. RSC Advances, 7, 46932-46937. https://doi.org/10.1039/c7ra09262h
29. Biao, L., Tan, S., Wang, Y., Guo, X., Fu, Y., Xu, F., Zu, Y. & Liu, Z. (2017). Synthesis, characterization and antibacterial study on the chitosan-functionalized Ag nanoparticles. Materials science & engineering. C, Materials for biological applications, 76, 73–80. https://doi.org/10.1016/j.msec.2017.02.154
30. Ebrahimzadeh, M.A., Derazkola, S.M. & Zazoul, M.A. (2019). Eco friendly green synthesis and characterization of novel Fe3O4/SiO2/ Cu2O–Ag nanocomposites using Crataegus pentagyna fruit extract for photocatalytic degradation of organic contaminants. Journal of Materials Science: Materials in Electronics, 30, 10994–11004. https://doi.org/10.1007/s10854-019-01440-8
31. Dizaji, A.N., Yilmaz, M. & Piskin, E. (2016). Silver or gold deposition onto magnetite nanoparticles by using plant extracts as reducing and stabilizing agents. Artificial cells, nanomedicine, and biotechnology, 44(4), 1109–1115. https://doi.org/10.3109/21691401.2015.1019672
32. Haque, M.A., Imamura, R., Brown, G.A., Krishnamurthi, V.R., Niyonshuti, I.I., Marcelle, T., Mathurin, L.E., Chen, J. & Wang, Y. (2017). An experiment-based model quantifying antimicrobial activity of silver nanoparticles on Escherichia coli. RSC Advances, 7, 56173-56182. https://doi.org/10.1039/C7RA10495B
33. Rajabi, S., Ramazani, A., Hamidi, M. & Naji, T. (2015). Artemia salina as a model organism in toxicity assessment of nanoparticles. Daru Journal of Pharmaceutical Sciences, 23(1), 20. https://doi.org/1186/s40199-015-0105-x.
34. Santos Filipe, M., Isca, V.M.S., Ntungwe, N.E., Princiotto, S., Díaz-Lanza, A.M. & Rijo, P. (2022). Lethality Bioassay using Artemia salina Journal of Visualized Experiments, 188, e64472. https://doi.org/10.3791/64472.
