| Artigos de Revisão, Biomed Biopharm Res., 2023; 20(1):106-125 doi: 10.19277/bbr.20.1.307; versão PDF [+]; html em inglês [EN] |
Métodos para avaliação da penetração cutânea de filtros solares orgânicos – uma revisão
Débora Quintas Balla 1 ![]() , Alicio Vitorino de Souza Neto 1
, Alicio Vitorino de Souza Neto 1 ![]() , Renata Miliani Martinez 2
, Renata Miliani Martinez 2 ![]() & Alexandra de Almeida Hübner 2
& Alexandra de Almeida Hübner 2 ![]() , Catarina Rosado 3
, Catarina Rosado 3 ![]() , André Rolim Baby 2
, André Rolim Baby 2 ![]() , Fabiana Vieira Lima1
, Fabiana Vieira Lima1 ![]() ✉️
✉️
1 - Laboratory of Pharmaceutical Technology, Department of Health Science, Federal University of Espírito Santo, São Mateus, ES, Brazil
2 - Department of Pharmacy, Faculty of Pharmaceutical Sciences, University of São Paulo, São Paulo, SP, Brazil
3 - CBIOS - Center for Biosciences & Health Technologies, Universidade Lusófona de Humanidades e Tecnologias, Campo Grande 376, 1749-024 Lisboa, Portugal
Resumo
Protetores solares são cosméticos amplamente usados atualmente, visto que a população tem se conscientizado cada vez mais dos danos que a radiação ultravioleta causa na pele, como envelhecimento precoce e câncer de pele. Porém os filtros solares podem ser tóxicos ao organismo quando penetram na pele. Para que sejam eficazes, os filtros solares precisam se depositar nas camadas mais externas do estrato córneo, pois sua penetração até a derme pode proporcionar efeitos sistêmicos. O objetivo deste estudo foi realizar uma revisão de publicações no período dos anos 2000 a 2020, agrupando estudos de penetração de filtros solares. Neste contexto, destaca-se o uso de métodos in vitro e in vivo que avaliaram a penetração destes, como a técnica de tape stripping e o sistema de difusão de célula de Franz, que combinadas a métodos analíticos como cromatografia líquida de alta eficiência e espectrofotometria, permitiram traçar um perfil da penetração dessas substâncias e elucidar fatores que interferem na sua penetração. Ademais, estudos vêm sendo realizados com estratégias de veiculação que visam encapsular as moléculas de filtros solares, e/ou alterar suas características físico-químicas, visando aumento da eficácia e segurança do usuário.
Palavras-chave: Célula de Franz; filtros solares; penetração cutanea; tape stripping
Como Citar: Quintas Balla, D., Vitorino de Souza Neto, A., Miliani Martinez, R., de Almeida Hübner, A., Rosado, C., Rolim Baby, A., Vieira Lima, F. (2023) Methods for cutaneous penetration assessment of organic UV filters - a review. Biomedical and Biopharmaceutical Research, 20(1), 106-125.
Correspondência a:
Recebido 03/04/2023; Aceite 31/05/2023
Introdução
A pele é o maior órgão humano em extensão e de relevância para aplicação de substâncias farmacológicas e cosméticas. Neste contexto, enfatiza-se a importância de estudos do comportamento de ativos químicos quando aplicados sobre a pele e, seu mecanismo de penetração pelo estrato córneo (EC). O EC atua na pele, como uma barreira de difusão e por isso, uma série de características físico-químicas da formulação aplicada deve ser levada em conta para esta análise (1).
Os protetores solares estão entre as formulações mais comuns utilizadas sobre a pele, especialmente porque a exposição à radiação ultravioleta (RUV) está associada a vários efeitos nocivos como câncer de pele, eritema e envelhecimento precoce da pele (2). Os filtros solares são definidos pelos órgãos regulamentadores como substâncias com a finalidade exclusiva e/ou principal de proteger a pele contra RUV absorvendo, dispersando ou refletindo a radiação (3,4).
Os filtros solares podem ser classificados quanto ao seu mecanismo de ação em filtros químicos (ou orgânicos) e em filtros físicos (ou inorgânicos). Para serem eficazes os filtros químicos precisam se acumular no EC, pois agem absorvendo a RUV. Os filtros físicos por sua vez, devem permanecem na superfície da pele, formando um filme, refletindo a RUV (5).
Os filtros solares ao penetrarem no estrato córneo podem permear através da pele até a circulação sistêmica. O EC é a barreira primária para a penetração de substâncias, podendo atuar também como reservatório dessas substâncias que são aplicadas sobre a pele (6).
O mecanismo de penetração envolve a entrada da molécula do filtro solar na camada mais superficial da pele, mas não requer a passagem dela de uma camada para outra como ocorre no movimento de permeação (7). Uma vez que influencia a partição da formulação e a sua difusão na pele, a lipofilicidade das moléculas activas é um dos mecanismos mais significativos que facilitam esta permeação, e é uma propriedade importante a ser estudada para compreender a penetração dos protectores solares na SC (8).
A penetração é o primeiro passo para que os filtros alcancem as camadas vascularizadas da pele, o que pode desencadear efeitos tóxicos (9). Ademais, a permeação dos filtros pode acarretar na perda da fotoproteção, pelo fato de sua ação fotoprotetora depender das moléculas permanecerem nas camadas mais superficiais do EC (10,11).
Diversos métodos para a avaliação da penetração e permeação de substâncias no EC tem sido aplicada, assim, o objetivo deste trabalho foi realizar uma revisão da literatura a respeito dos diferentes métodos in vitro e in vivo utilizados para o estudo de penetração de filtros solares químicos na pele, assim como, os fatores que podem influenciar no perfil de penetração dos mesmos na pele.
Material e Métodos
As bases utilizadas para busca foram: Google Acadêmico, Scielo, Pubmed, Scopus e Periódicos CAPES. As palavras-chave utilizadas para a pesquisa foram “sunscreen” e “penetration”. O período de publicação selecionado para a pesquisa compreendeu publicações dos anos 2000 a 2020, encontrando no total 20.277 resultados. A partir dos resultados encontrados, realizou-se a seleção por título onde foram selecionados 398 resultados. Os critérios de exclusão dos títulos utilizados foram: a não presença dos termos buscados, a não utilização de métodos que avaliem a penetração dos filtros, ausência de filtros químicos e estudos de revisão. Foi utilizada a plataforma Mendeley Desktop para realização da seleção, leitura dos resumos e exclusão das duplicatas. Após a leitura dos resumos foram selecionados 122 artigos. Os mesmos critérios de exclusão foram utilizados após a leitura dos artigos, resultando na seleção de 61 artigos para esta revisão.
Resultados e Discussão
Os artigos foram analisados em relação à metodologia utilizada para avaliação da penetração e/ou permeação dos filtros solares na pele, quanto ao substrato utilizado como modelo para análise e quanto aos resultados apresentados.
Para unificar a nomenclatura dos filtros solares foi utilizada a nomenclatura internacional de ingredientes cosméticos (INCI), outros sinônimos e detalhes podem ser encontrados na Tabela Suplementar. Entre os filtros UV mais encontrados nessa revisão destacaram-se butyl methoxydibenzoylmethane, ethylhexyl methoxycinnamate, e benzophenone-3 (Tabelas 1, 2 e 3 respectivamente). Na Tabela 4 detalha-se lista filtros solares encontrados isoladamente, e na Tabela 5, em associação, assim como os veículos utilizados, a metodologia empregada e o substrato que foi utilizado como modelo de estudo.
| Tabela 1 - Lista de artigos para o filtro solar butyl methoxydibenzoylmethane. |
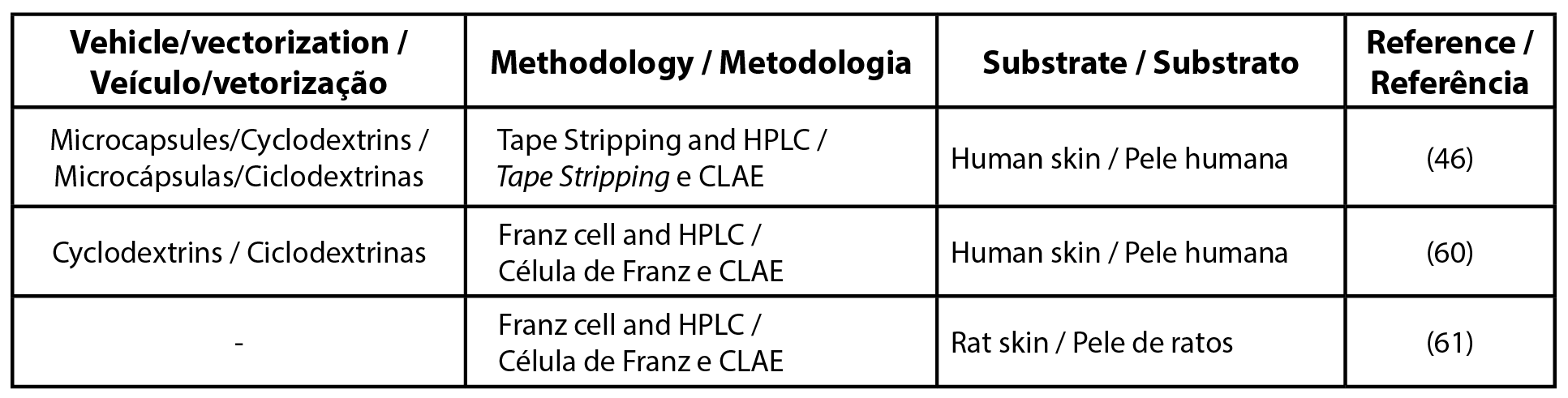 |
| Legenda: CLAE - cromatografia líquida de alta eficiência |
| Tabela 2 – Lista de artigos para o filtro solar ethylhexyl methoxycinnamate |
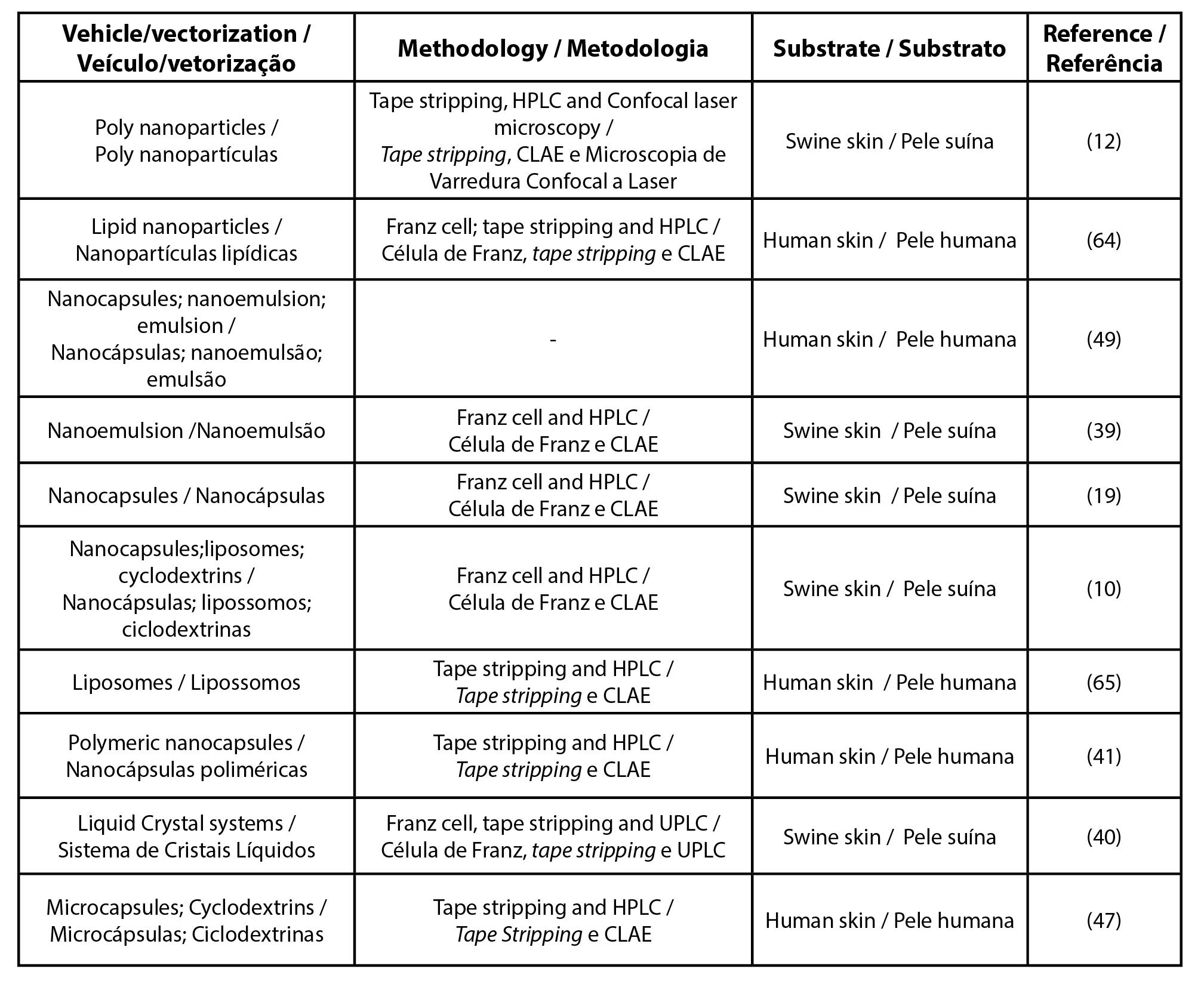 |
| Legenda: CLAE - cromatografia líquida de altaeficiência; UPLC - cromatografia líquida de ultra eficiência |
| Tabela 3 – Lista de artigos para o filtro solar benzofenona-3 |
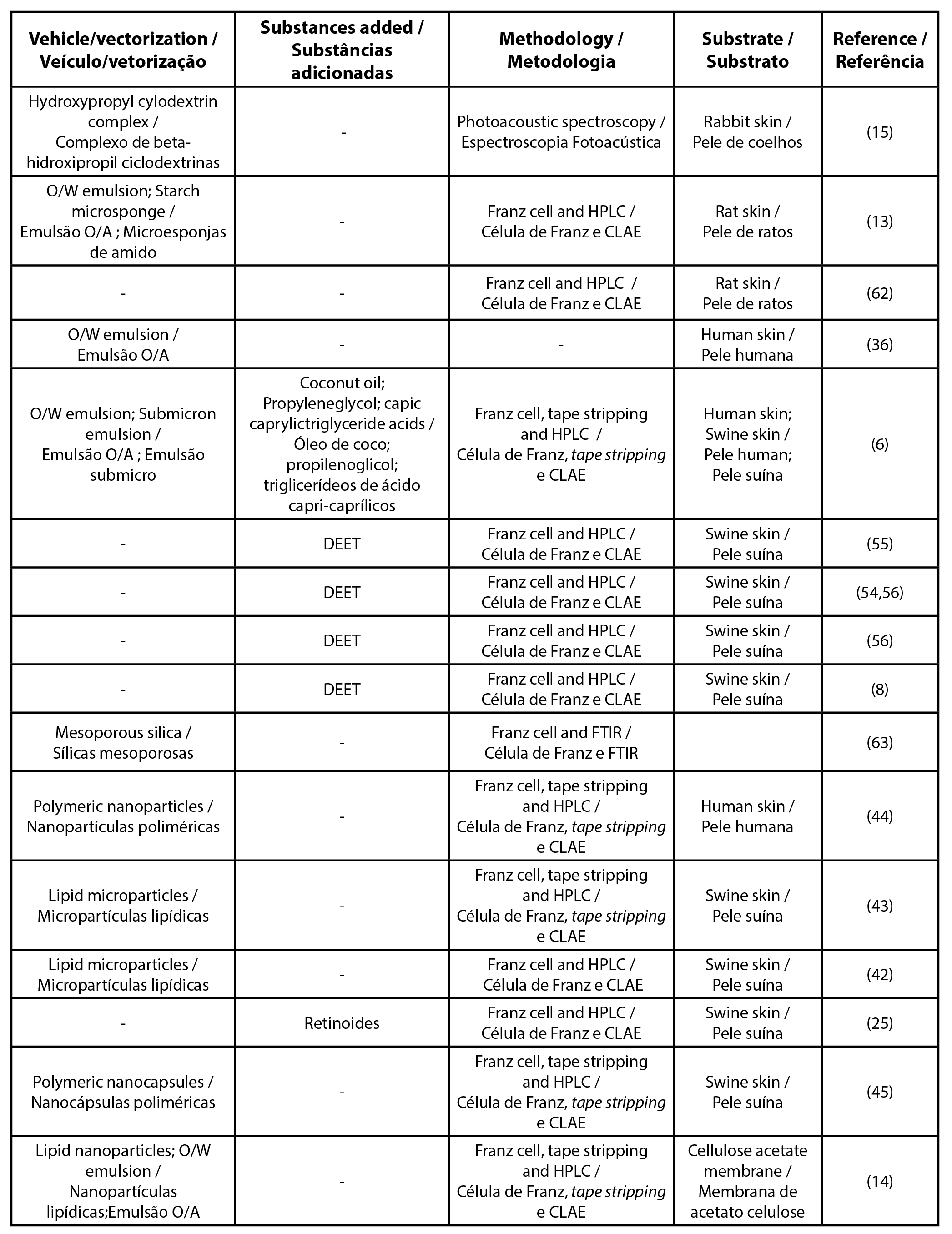 |
| Legenda: CLAE - cromatografia líquida de alta eficiência; O/A - óleo/água; A/O - água/óleo; DEET - N,N-Dietil-m-toluamida |
| Tabela 4 - Lista de artigos por filtro solar encontrado isoladamente. |
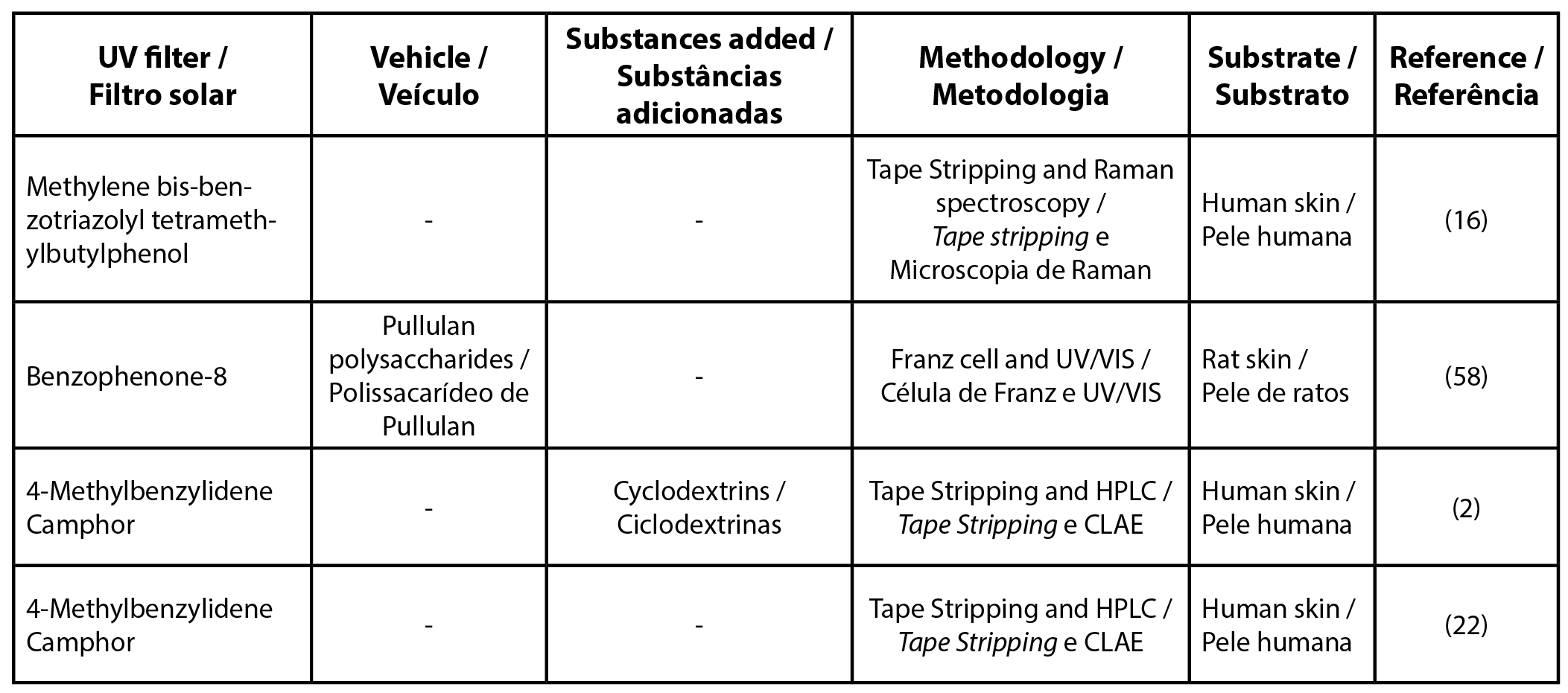 |
| Legenda: CLAE - cromatografia líquida de alta eficiência |
| Tabela 5 - Lista de artigos para filtros solares em associação. |
 |
| Legenda: CLAE - cromatografia líquida de altaeficiência; UPLC - cromatografia líquida de ultra eficiência. |
Parte dos estudos encontrados dedicava-se a encontrar formulações que pudessem auxiliar na retenção dos filtros no EC, evitando a permeação dos filtros até a derme e hipoderme por meio de encapsulação dos filtros, com o uso de nano e micropartículas por exemplo e serão destacados a seguir.
A técnica de tape stripping e a utilização de difusão por meio de células de Franz foram os achados mais comuns entre os estudos. Alguns autores optaram por utilizar os dois métodos no mesmo estudo, a fim de avaliar a penetração de filtros in vivo e in vitro. Outros métodos também foram utilizados pelos investigadores, como espectroscopia fotoacústica, mapeamento microscópico de Ramam e microscopia eletrônica (12-17).
O substrato utilizado como modelo de estudo também apresentou variações, como o de pele de ratos (18), coelhos (15), porcos (19) e pele humana (20), quando realizado o estudo in vitro.
Tape stripping
A avaliação da penetração dos filtros UV na pele é relevante para determinar a segurança dos utilizados em formulações de protetores solares. Estudos foram desenvolvidos para aprimoramento de técnicas que tornassem possível traçar o perfil de penetração dessas substâncias, entre elas, a técnica de tape stripping tem sido muito empregada, sendo um dos métodos mais comuns para avaliação da penetração de substâncias no EC.
Essa metodologia é realizada por meio da aplicação e remoção de fitas adesivas sucessivamente em uma área da pele, que precisa estar limpa e livre de pelos. Essas fitas que são aplicadas no mesmo local de pele, quando retiradas sucessivamente podem conter uma camada inteira de EC, sendo a primeira fita com a camada mais superficial de células e as demais fitas com camadas mais profundas (21).
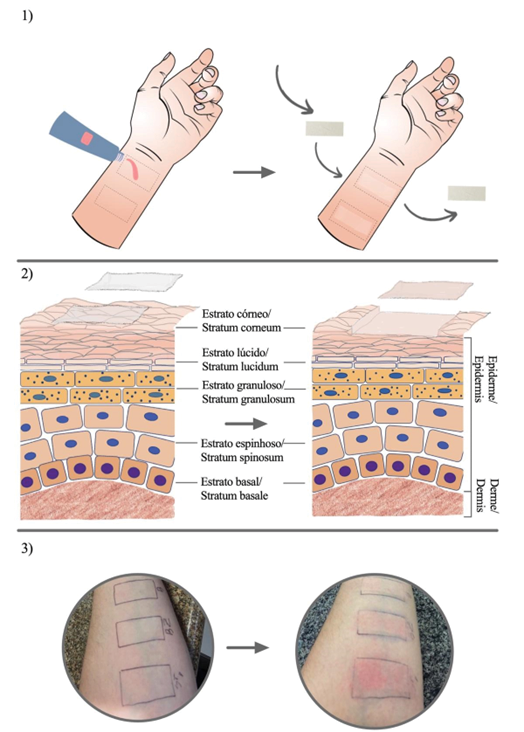
Os agregados de corneócitos junto com as substâncias que foram aplicadas topicamente são transferidos para as fitas, depois são analisadas por métodos espectrométricos para quantificar as mesmas na camada de estrato córneo retirada com as fitas. Um dos métodos utilizados é a espectrofotometria UV/VIS que permite determinar a quantidade de substâncias no EC removido em cada uma das fitas, podendo assim determinar se o EC foi retirado de forma homogênea (22). A Figura 1 mostra o passo a passo da aplicação do método no braço de um voluntário.
| Figura 1 - Representação do método de tape stripping: 1) A área é demarcada e quantidade específica do produto é aplicado, e após tempo determinado as fitas são aplicadas e retiradas sucessivamente do mesmo local; 2) Representação das camadas da pele e camadas superficiais do estrato córneo retirado pelas fitas; 3) Fotografias demonstrando o procedimento antes e após a retirada das fitas no local de aplicação. |
 |
Uma benefício da técnica de tape stripping é que ela pode ser empregada para estudos in vivo, utilizando voluntários para a aplicação das substâncias (6,16); o que torna o estudo mais realista simulando as condições de uso da formulação (23).
Essa metodologia também pode ser aplicada in vitro, quando utilizada em conjunto com a célula de Franz, no qual o EC do modelo biológico que está sendo estudado é retirado com fitas adesivas, tornando possível traçar o perfil de penetração no EC e o perfil de permeação das substâncias ao mesmo tempo, os modelos usados nesses casos podem ser pele humana, advinda de cirurgias plásticas ou outros modelos como a pele de porco (24,25).
Alguns estudos, que utilizaram essa metodologia para avaliar a penetração de filtros, demonstraram que a maior parte dos filtros aplicados na pele, pôde ser recuperada nas primeiras fitas, ou seja, penetrando apenas nas camadas mais superficiais do EC sem evidência de que possa se considerar uma penetração profunda a ponto de encontrar a circulação sistêmica, mas que essa penetração depende do quanto a molécula é lipofílica, apresentando maior afinidade pelo EC, como é o caso da benzofenona-3 (24,26).
Outro benefício de se utilizar tape stripping é que o método pode avaliar a penetração em um curto período de tempo e com uma pequena quantidade do filtro aplicada sobre a pele (27). No entanto, Couteau et al. (2001) demonstraram que ao avaliar a penetração em um período maior de tempo, o teor de recuperação dos filtros diminui, levando a concluir que quanto maior o tempo que os filtros permanecem sobre a pele, maior é a sua penetração (28).
Ao fazer uma comparação entre as técnicas empregadas para avaliar a penetração dos filtros solares na pele, tape stripping para um estudo in vivo e célula de Franz para uma análise in vitro, os investigadores perceberam que ambas as técnicas, quando utilizadas em conjunto poderiam auxiliar na criação de novas formulações de protetores solares, visto que o modelo de estudo in vivo traz informações sobre a penetração dos filtros nos EC e o modelo de estudo in vitro pode ajudar na triagem de novas moléculas que podem atuar como filtros solares e novos veículos para as formulações (14).
A técnica de tape stripping também pode ser empregada junto com outros métodos analíticos como a microscopia confocal de Raman que permite a visualização do conteúdo das fitas obtendo uma visão tridimensional da distribuição dos filtros no EC (16). Também foi utilizada em conjunto com métodos espectrométricos, como a espectroscopia fotoacústica, que permite avaliar a profundidade do perfil de penetração dos filtros através do comprimento de difusão térmica (15). Gebauer et al. (2012) demonstraram que essa técnica atrelada ao tape stripping é útil na análise da homogeneidade que o filtro UV está distribuído no EC (29). No entanto, Haque et al. (2016) observou que alguns excipientes utilizados na formulação podem interferir na adesão das fitas (30).
Em relação aos resultados encontrados, sobre a recuperação dos filtros em estudos que utilizaram a técnica de tape stripping, nota-se que a maioria dos filtros possui teor de recuperação em cerca de 90%, como demonstrado para o methylene bis-benzotriazolyl tetramethylbutylphenol - 91,1%, para o ethylhexyl methoxycinnamate – 103.5%, para o diethylamino hydroxybenzoyl hexyl benzoate – 101,1%; para o bis-ethylhexyloxyphenol methoxyphenyl triazine - 90,6% (16,31).
Célula de Franz
Esse procedimento permite avaliar a permeação de substâncias topicamente aplicadas no EC. Ela consiste em duas células, uma receptora e uma doadora. Na célula doadora é depositado o filtro a ser estudado e na célula receptora há uma solução onde o composto se difunde. As duas células são separadas por uma membrana, equipadas com uma barra magnética para manter a solução de difusão homogênea (32).
Como membrana, diversos tecidos podem ser utilizados como por exemplo pele humana, ou modelos advindos de animais como porcos, ratos ou coelhos (31-33). O lado da derme do modelo cutâneo é posicionado junto a célula receptora, e a lado de EC junto a célula doadora conforme Figura 2. Com a célula de Franz é possível avaliar se há permeação transdérmica dos filtros, mas o modelo utilizado deve ser observado, pois a pele suína que possui maior permeabilidade que a pele humana, e isto deve ser considerado nos estudos que utilizam essa técnica a fim de evitar vieses (30).
|
Figura 2 - Representação do sistema de difusão Célula de Franz: A) Partes da célula; B) Célula montada; C e D) Células em banho maria 37oC. |
 |
Muitos dos estudos encontrados nesta revisão utilizaram a célula de Franz como fonte de pesquisa para a permeação de substância na pele em combinação com a técnica de tape stripping, usando métodos analíticos para quantificar a penetração e permeação das substâncias com um modelo de pesquisa in vivo e in vitro (6).
Modelos de estudo
É possível realizar estudo de penetração e permeação com vários modelos de estudo, sendo os encontrados nessa revisão, membranas artificiais, pele humana, suína, ratos e de coelhos. Nesta revisão, diferentes tipos de pele como humanas, de porco, ratos e coelhos foram encontradas (Tabela 1-5).
A utilização de pele humana é a mais indicada para o estudo de penetração de filtros solares pois é a ela que o produto se destina. Os estudos podem ser realizados in vivo quando realizada em voluntários, ou in vitro quando é feito o uso de pele retirada de cirurgias plásticas geralmente da região abdominal ou da região dos seios (20).
Quando é utilizada a pele suína, muitos pesquisadores preferem utilizar a pele retirada da orelha, sendo considerada um modelo de estudo por ser muito similar a pele humana (34). No entanto, quando comparada a pele humana, utilizando o método de tape stripping, é possível retirar uma maior quantidade EC na pele suína (30).
Fatores que determinam a difusão dos filtros solares na pele
Dentre os fatores que determinam a difusão dos filtros solares na pele estão: características físico-químicas, veículo utilizado na formulação, concentração das moléculas e o estado da pele (31). Serão destacados a seguir dois desses fatores: as características físico-químicas e o veículo das formulações.
Uma característica importante a ser observada é o quanto a molécula é lipofílica. Filtros lipofílicos como a benzophenone-3, ethylhexyl methoxycinnamate, 2-ethylhexyl salicylate possuem mais facilidade de penetrar no EC (27,35). No entanto, a pele apresenta sítios hidrofílicos e lipofílicos, e o coeficiente de partição (log P n-octanol/água) pode ser usado para estudo da penetração dessas moléculas. Se o coeficiente de partição for muito baixo, as moléculas são mais hidrossolúveis e não passam a barreira do estrato córneo, por outro lado se for muito alto a lipoficilidade aumenta e as moléculas são tão solúveis que permanecem dissolvidas no EC. Estudo anterior mostrou que a penetração percutânea apresentou comportamentos preditivos de acordo com log P, considerado o log P 1 como ideal para penetração percutânea (31).
Veículo e vetorização
Há diversas formas de alterar a penetração dos filtros solares, como por exemplo alterar as propriedades físicas e químicas da formulação, entre elas, o aumento da viscosidade da formulação (26,36).
O veículo utilizado é muito importante na formulação, pois ele pode influenciar na absorção cutânea, aumentando ou bloqueando a passagem do filtro UV na pele (26). Portanto, deve ser cuidadosamente escolhido para evitar a penetração dos filtros solares na pele (37).
Foi demonstrado por Chatelain et al. (2003) que de fato, a penetração dos filtros é dependente do veículo usado na formulação pois nesse estudo os filtros benzophenone-3, ethylhexyl methoxycinnamate, 2-ethylhexyl salicylate, homosalate e butyl methoxydibenzoylmethane tiveram maiores taxas de recuperação quando em formulações que tinham como veículo um creme gel em vez de um veículo de vaselina (38). O Fator de Proteção Solar (FPS) se manteve mais elevado quando o veículo era constituído de um creme gel, demonstrando que os filtros mantiveram nas camadas mais superficiais do EC. No entanto, emulsões O/A demonstraram ser potencializadoras da penetração da benzofenona-4 (28).
Encapsular as moléculas do filtro solar tem se mostrado uma estratégia de formulação para aumentar a estabilidade e a eficácia de produtos contendo filtros solares (33). Foi demonstrado que nanoemulsões também podem auxiliar na manutenção dos filtros nas camadas mais superficiais do EC (39).
Outros estudos revelaram que a utilização de sistemas de cristais líquidos podem diminuir a permeabilidade do ethylhexyl methoxycinnamate na pele (40) , assim como o uso nanocápsulas como veículo pode reduzir a penetração do ethylhexyl methoxycinnamate, formando um filme na superfície e diminuindo a penetração no EC (19,33) . Por outro lado, o tamanho dessas nanopartículas deve ser levado em conta, pois partículas com tamanho maior que 10 µm permanecem na superfície da pele e partículas menores que 3 µm distribuem-se pelos folículos capilares e pelo EC (41).
O uso de microsferas lipídicas sólidas como veículo apresentou uma diminuição na penetração de ethylhexyl triazone e de benzophenone-3, sendo sugerido pelos autores Mestres et al. (2010) como o veículo ideal para formulações contendo esses filtros (23,42). Os autores Martins et al. (2014) sugerem também a formulação dessas microesferas com ceras naturais como as de abelha e de carnaúba (43). Por outro lado, a utilização de nanoestruturas poliméricas e microesponjas de amido se mostraram eficientes em reduzir a permeação da benzophenone-3 na pele e até mesmo levar a um aumento do fator de proteção solar (13,44).
Siqueira et al. (2011) demonstraram também que nanocápsulas contendo quitosana apresentam eficiência em manter a benzophenone-3 nas camadas mais superficiais do EC, e que fórmulas contendo essas nanocápsulas podem evitar a distribuição sistêmica da mesma (45). Outros estudos demonstram que a utilização de microcápsulas de beta ciclodextrina, bem como o uso de micropartículas lipídicas incorporadas aos filtros ethylhexyl methoxycinnamate e butyl methoxydibenzoylmethane, foram capazes de reduzir a penetração da butyl methoxydibenzoylmethane através do EC, efeito importante para garantir a proteção aos raios UV e também limitar potenciais reações tóxicas por parte desses filtros (46–48).
Estudo conduzido por Calderilla-Fajardo et al. (2006) com o filtro solar ethylhexyl methoxycinnamate demonstrou que o uso de nanocápsulas e de nanoemulsões além de alterar a diminuir a penetração dos filtros aumentando a retenção dos filtros no estrato córneo, foi capaz de aumentar seu fator de proteção solar (49,50).
Estudo conduzido por Wissing & Müller (2002) mostrou que, nanopartículas lipídicas sólidas foram capazes de fazer com que a benzophenone-3 permanecesse por mais tempo na superfície da pele, mantendo sua função de proteção solar (14).
Influências de outras substâncias
O uso de adjuvantes nas formulações pode auxiliar ou não na penetração dos filtros na pele. Fernandez et al. (2000) mostraram que o óleo de coco e de trigliceriídeos de ácido cáprico e caprílico como solventes para os filtros UV possuem o papel de limitar a permeação cutânea (6).
Outro estudo, demonstrou que, o Transcutol® CG (diethylene glycol monoethyl ether) adicionando à bases transdérmicas, facilitou o acúmulo dos filtros benzophenone-3 e ethylhexyl methoxycinnamate no EC (51).
Alguns filtros solares podem atuar como potencializadores da penetração de outras substâncias. Estudos demonstram que seis de nove produtos testados [ethylhexyl methoxycinnamate, 2-ethylhexyl salicylate, benzophenone-3, benzophenone-4, ethylhexyl dimethyl PABA e homosalate] podem aumentar a penetração do ácido diclorofenoxiacético (2,4-D) um herbicida usado por trabalhadores rurais (52,53).
Visto que há no mercado formulações que possuem função repelente e de proteção solar, alguns estudos demonstram que filtros solares podem penetrar mais na pele quando aplicados junto com o uso de repelentes, como a benzofenona-3 que pode penetrar cerca de 89% mais, quando um repelente, DEET (N,N-diethyl-m-toluamide), é aplicado sobre ela, apresentando um efeito sinérgico (54–56). No entanto, há publicações que demonstram que a adição de antioxidantes como o trans-resveratrol e o betacaroteno também podem mudar o perfil de penetração dos filtros, aumentando seu FPS e diminuindo sua penetração no EC (57).
Determinados filtros solares precisam ser estabilizados na formulação, como é o caso da 4-methylbenzilidene camphor, um filtro que se encontra atualmente em desuso. Uma das formas de estabilização utilizada é por meio de complexos de ciclodextrinas, porém Scalia et al. (2007) (2) observaram que esses complexos não influenciam no perfil de penetração da 4-methylbenzilidene camphor. Heo et al. (2018) adicionaram polissacarídeos de pullulan a benzophenone-8, um polissacarídeo natural, demonstrando que a formação desse conjugado pode aumentar o tempo que o filtro fica retido na pele (58).
Finalmente, um estudo observou a influência da cafeína em aumentar cerca de 25% a ação fotoprotetora UVB associada a boa compatibilidade cutânea (59).
Conclusão
Através da revisão dos artigos nesse estudo é possível concluir que o uso de apenas uma metodologia pode ser considerada para a avaliação da penetração de filtros solares, porém a combinação de técnicas como a célula de Franz e tape stripping pode revelar o perfil completo de permeação e penetração dos filtros solares na pele.
A técnica de tape stripping revela o perfil de penetração dos filtros associado à métodos analíticos como a cromatografia líquida de alta eficiência e métodos espectrométricos. Observa-se que a penetração dos filtros no EC não significa que os filtros tiveram uma passagem transdérmica, por essa razão deve se levar em conta o teor de recuperação dos filtros e observar em quais camadas do EC este teor foi maior, visto que um maior teor de recuperação nas primeiras fitas sugere a não permeação do filtro.
Para avaliar se há permeação transdérmica o método de difusão por célula de Franz, é o mais indicado, porque este avalia a passagem dessas substâncias em todas as camadas da pele, incluindo epiderme e derme, sendo possível avaliar se os filtros solares analisados poderiam estar disponíveis para alcançar a circulação sanguínea e atuar sistemicamente.
Vários fatores podem influenciar os resultados de penetração dos filtros solares, como o substrato utilizado, as características físico-químicas como o coeficiente de partição e a lipofilicidade da molécula, os veículos utilizados, a adição de outras substâncias e a vetorização destes.
Nota-se que o emprego desses métodos é importante para garantir a segurança e eficácia dos protetores solares, visto que filtros como a benzophenone-3, ethylhexyl methoxycinnamate e butyl methoxydibenzoylmethane por exemplo, apresentaram vários relatos que sugerem penetração na pele, e ainda são muito utilizados em diversas formulações de protetores solares.
Contribuições autorais
Conceituação, D.Q.B, A.V.S.N., F.V.L.; metodologia, D.Q.B, F.V.L.; análise formal, C.R., R.M.M., A.R.B.; investigação, D.Q.B, A.V.S.N., F.V.L.; redação, D.Q.B, R.M.M., A.A.H.: preparação original do rascunho, D.Q.B.; redação e edição, D.Q.B., R.M.M., F.V.L.; supervisão, F.V.L.; administração de projetos, F.V.L.; aquisição de financiamento, D.Q.B.; F.V.L. Todos os autores leram e concordaram com a versão publicada do manuscrito.
Financiamento
Os autores agradecem a Fundação de Amparo à Pesquisa e Inovação do Espírito Santo (FAPES) pela bolsa de iniciação científica.
Conflitos de Interesse
Os editores envolvidos na autoria desses manuscritos não tiveram participação no processo de revisão ou decisão. Todos os autores declararam que não existirem relações financeiras e/ou pessoais que possam representar um potencial conflito de interesses.
Referências
1. Alves, N.C. (2015) Penetração de ativos na pele: revisão bibliográfica. Amazônia Science & Health, 3(4), 36–43. https://doi.org/10.18606/2318-1419/amazonia.sci.health.v3n4p36-43
2. Scalia, S., Tursilli, R., & Iannuccelli, V. (2007) Complexation of the sunscreen agent, 4-methylbenzylidene camphor with cyclodextrins: Effect on photostability and human stratum corneum penetration. Journal of Pharmaceutical and Biomedical Analysis, 44(1), 29–34. https://doi.org/10.1016/j.jpba.2007.01.016
3. BRASIL. (2012) Resolução. RDC no 30, de 1o de junho de 2012. Aprova o Regulamento Técnico Mercosul sobre Protetores solares em Cosméticos e dá outras providências, 1-7.
4. EUROPEAN UNION. (2009) Regulation (EC) no 1223/2009 of the European Parliament and of the Council of 30 November 2009 on cosmetic products. Official Journal of the European Union L, 342, 59-202.
5. Flor, J., Davolos, M.R., & Correa, M.A. (2007) Protetores solares. Química Nova, 30(1), 153–158. https://doi.org/10.1590/S0100-40422007000100027
6. Fernandez, C., Marti-Mestres, G., Ramos, J., & Maillols, H. (2000) LC analysis of benzophenone-3: II application to determination of “in vitro” and “in vivo” skin penetration from solvents, coarse and submicron emulsions. Journal of Pharmaceutical and Biomedical Analysis, 24(1), 155–165. https://doi.org/10.1016/S0731-7085(00)00399-X
7. Bolzinger, M.A., Briançon, S., Pelletier, J., & Chevalier, Y. (2012) Penetration of drugs through skin, a complex rate-controlling membrane. Current opinion in colloid & interface science, 17(3), 156–165. https://doi.org/10.1016/j.cocis.2012.02.001
8. Kasichayanula, S., House, J.D., Wang, T., & Gu, X. (2007) Percutaneous characterization of the insect repellent DEET and the sunscreen oxybenzone from topical skin application. Toxicology and Applied Pharmacology, 223(2), 187–194. https://doi.org/10.1016/j.taap.2007.05.016
9. Balaguer, A., Salvador, A., Chisvert, A., Meliá, M., Herráez, M., & Díez, O. (2006) A liquid chromatography-fluorimetric method for the in vitro estimation of the skin penetration of disodium phenyldibenzimidazole tetrasulfonate from sunscreen formulations through human skin. Analytical and Bioanalytical Chemistry, 385(7), 1225–1232. https://doi.org/10.1007/s00216-006-0344-2
10. Monteiro, M.S.S.B., Ozzetti, R.A., Vergnanini, A.L., Brito-Gitirana, L., Volpato, N.M., Freitas, Z.M.F., Ricci-Júnior, E., & Santos, E.P. (2012) Evaluation of octyl p-methoxycinnamate included in liposomes and cyclodextrins in anti-solar preparations: preparations, characterizations and in vitro penetration studies. International Journal of Nanomedicine, 7, 3045–3058. https://doi.org/10.2147/IJN.S28550
11. Souza, C., & Maia Campos, P.M.B.G. (2017) Development of a HPLC method for determination of four UV filters in sunscreen and its application to skin penetration studies. Biomedical Chromatography, 31(12), e4029. https://doi.org/10.1002/bmc.4029
12. Alvarez-Román, R., Naik, A., Kalia, Y., Guy, R., & Fessi, H. (2004) Enhancement of Topical Delivery from Biodegradable Nanoparticles. Pharmaceutical Research, 21(10), 1818–1825. https://doi.org/10.1023/b:pham.0000045235.86197.ef.
13. Bhuptani, R.S., & Patravale, V.B. (2019) Starch microsponges for enhanced retention and efficacy of topical sunscreen. Materials Science and Engineering C, 104, 109882. https://doi.org/10.1016/j.msec.2019.109882
14. Wissing, S.A., & Müller, R.H. (2002) Solid lipid nanoparticles as carrier for sunscreens: in vitro release and in vivo skin penetration. Journal of Controlled Release, 81(3), 225–233. https://doi.org/10.1016/S0168-3659(02)00056-1
15. Berbicz, F., Nogueira, A.C., Neto, A.M., Natali, M.R.M., Baesso, M.L., & Matioli, G. (2011) Use of photoacoustic spectroscopy in the characterization of inclusion complexes of benzophenone-3-hydroxypropyl-β-cyclodextrin and ex vivo evaluation of the percutaneous penetration of sunscreen. European Journal of Pharmaceutics and Biopharmaceutics, 79(2), 449–457. https://doi.org/10.1016/j.ejpb.2011.03.026
16. Adlhart, C., & Baschong, W. (2011) Surface distribution and depths profiling of particulate organic UV absorbers by Raman imaging and tape stripping. International Journal of Cosmetic Science, 33(6), 527–534. https://doi.org/10.1111/j.1468-2494.2011.00666.x
17. Bolzinger, M.A., Briançon, S., & Chevalier, Y. (2011) Nanoparticles through the skin: managing conflicting results of inorganic and organic particles in cosmetics and pharmaceutics. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 3(5), 463–478. https://doi.org/10.1002/wnan.146
18. Brand, R., McMahon, L., Jendrzejewski, J., & Charron, A. (2007) Transdermal absorption of the herbicide 2,4-dichlorophenoxyacetic acid is enhanced by both ethanol consumption and sunscreen application. Food and Chemical Toxicology, 45(1), 93–97. https://doi.org/10.1016/j.fct.2006.08.005
19. Jiménez, M.M., Pelletier, J., Bobin, M.F., & Martini, M.C. (2004) Influence of encapsulation on the in vitro percutaneous absorption of octyl methoxycinnamate. International Journal of Pharmaceutics, 272(1–2), 45–55. https://doi.org/10.1016/j.ijpharm.2003.11.029
20. Puglia, C., Damiani, E., Offerta, A., Rizza, L., Tirendi, G.G., Tarico, M.S., Curreri, S., Bonina, F., & Perrotta, R.E. (2014) Evaluation of nanostructured lipid carriers (NLC) and nanoemulsions as carriers for UV-filters: Characterization, in vitro penetration and photostability studies. European Journal of Pharmaceutical Sciences, 51(1), 211–217. https://doi.org/10.1016/j.ejps.2013.09.023
21. Lademann, J., Jacobi, U., Surber, C., Weigmann, H.J., & Fluhr, J.W. (2009) The tape stripping procedure - evaluation of some critical parameters. European Journal of Pharmaceutics and Biopharmaceutics, 72(2), 317–323. https://doi.org/10.1016/j.ejpb.2008.08.008
22. Weigmann, H.J., Jacobi, U., Antoniou, C., Tsikrikas, G.N., Wendel, V., Rapp, C., Gers-Barlag, H., Sterry, W., & Lademann, J. (2005) Determination of penetration profiles of topically applied substances by means of tape stripping and optical spectroscopy: UV filter substance in sunscreens. Journal of Biomedical Optics, 10(1), 014009. https://doi.org/10.1117/1.1854683
23. Scalia, S., Battaglioli, S., & Bianchi, A. (2019) In vivo Human Skin Penetration of the UV Filter Ethylhexyl Triazone: Effect of Lipid Microparticle Encapsulation. Skin Pharmacology and Physiology, 32(1), 22–31. https://doi.org/10.1159/000493761
24. Potard, G., Laugel, C., Schaefer, H., & Marty, J.P. (2000) The Stripping Technique: In vitro Absorption and Penetration of Five UV Filters on Excised Fresh Human Skin. Skin Pharmacology and Physiology, 13(6), 336–344. https://doi.org/10.1159/000029941
25. Padula, C., Campana, N., & Santi, P. (2008) Simultaneous determination of benzophenone-3, retinol and retinyl acetate in pig ear skin layers by high-performance liquid chromatography. Biomedical Chromatography, 22, 1060–1065. https://doi.org/10.1002/bmc.1024
26. Fernandez, C., Marti-Mestres, G., Mestres, J.P., & Maillols, H. (2000) LC analysis of benzophenone-3 in pigskin and in saline solution: Application to determination of in vitro skin penetration. Journal of Pharmaceutical and Biomedical Analysis, 22(2), 393–402. https://doi.org/10.1016/S0731-7085(99)00277-0
27. Fernandez, C., Nielloud, F., Fortuné, R., Vian, L., & Marti-Mestres, G. (2002) Benzophenone-3: rapid prediction and evaluation using non-invasive methods of in vivo human penetration. Journal of Pharmaceutical and Biomedical Analysis, 28(1), 57–63. https://doi.org/10.1016/S0731-7085(01)00630-6
28. Couteau, C., Perez Cullel, N., Connan, A.E., & Coiffard, L.J.M. (2001) Stripping method to quantify absorption of two sunscreens in human. International Journal of Pharmaceutics, 222(1), 153–157. https://doi.org/10.1016/S0378-5173(01)00674-3
29. Gebauer, V., Weigmann, H.J., Schanzer, S., Meinke, M.C., Vergou, T., Sterry, W., & Lademann, J. (2012) Influence of skin aging effects on the skin surface profile and the correlated distribution of topically applied sunscreens. Journal of Biophotonics, 5(3), 274–282. https://doi.org/10.1002/jbio.201100104chatelain
30. Haque, T., Crowther, J.M., Lane, M.E., & Moore, D.J. (2016) Chemical ultraviolet absorbers topically applied in a skin barrier mimetic formulation remain in the outer stratum corneum of porcine skin. International Journal of Pharmaceutics, 510(1), 250–254. https://doi.org/10.1016/j.ijpharm.2016.06.041
31. Durand, L., Habran, N., Henschel, V., & Amighi, K. (2009) In vitro evaluation of the cutaneous penetration of sprayable sunscreen emulsions with high concentrations of UV filters. International Journal of Cosmetic Science, 31(4), 279–292. https://doi.org/10.1111/j.1468-2494.2009.00498.x
32. Oliveira, C.A.M. (2009) Estudos de permeação através da pele (Dissertação de Mestrado, Departamento de Química, Universidade de Aveiro, Portugal). Available: https://ria.ua.pt/bitstream/10773/4552/1/231152.pdf [Accessed: 17-abr-2023]
33. Vettor, M., Bourgeois, S., Fessi, H., Pelletier, J., Perugini, P., Pavanetto, F., & Bolzinger, M.A. (2010) Skin absorption studies of octyl-methoxycinnamate loaded poly(D,L-lactide) nanoparticles: Estimation of the UV filter distribution and release behaviour in skin layers. Journal of Microencapsulation, 27(3), 253–262. https://doi.org/10.3109/10717540903097770
34. Lin, Y.C., Lin, C.F., Alalaiwe, A., Wang, P.W., Fang, Y.P., & Fang, J.Y. (2018) UV filter entrapment in mesoporous silica hydrogel for skin protection against UVA with minimization of percutaneous absorption. European Journal of Pharmaceutical Sciences, 122, 185–194. https://doi.org/10.1016/j.ejps.2018.07.013
35. Sarveiya, V., Templeton, J., & Benson, H. (2004) Inclusion Complexation of the Sunscreen 2-Hydroxy-4-Methoxy Benzophenone (Oxybenzone) with Hydroxypropyl-b-Cyclodextrin: Effect on Membrane Diffusion. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 49(3–4), 275–281. https://doi.org/10.1007/s10847-004-6098-6
36. Cross, S.E., Jiang, R., Benson, H.A.E., & Roberts, M.S. (2001) Can Increasing the Viscosity of Formulations be used to Reduce the Human Skin Penetration of the Sunscreen Oxybenzone? Journal of Investigative Dermatology, 117(1), 147–150. https://doi.org/10.1046/j.1523-1747.2001.01398.x
37. Vilela, F.M.P., Fonseca, Y.M., Vicentini, F.T.M.C., Fonseca, M.J.V., & Do Amaral, M.D.P.H. (2011) Determination of three ultraviolet filters in sunscreen formulations and from skin penetration studies by high-performance liquid chromatography. Quimica Nova, 34(5), 879–883. https://doi.org/10.1590/S0100-40422011000500026
38. Chatelain, E., Gabard, B., & Surber, C. (2003) Skin Penetration and Sun Protection Factor of Five UV Filters: Effect of the Vehicle. Skin Pharmacology and Applied Skin Physiology, 16(1), 28–35. https://doi.org/10.1159/000068291
39. Hanno, I., Anselmi, C., & Bouchemal, K. (2012) Polyamide Nanocapsules and Nano-emulsions Containing Parsol® MCX and Parsol® 1789: In Vitro Release, Ex Vivo Skin Penetration and Photo-Stability Studies. Pharmaceutical Research, 29(2), 559–573. https://doi.org/10.1007/s11095-011-0592-5
40. Prado, A.H., Borges, M.C., Eloy, J.O., Peccinini, R.G., & Chorilli, M. (2017) An ultra-high performance liquid chromatography method to determine the skin penetration of an octyl methoxycinnamate-loaded liquid crystalline system. Pharmazie, 72(10), 563–567. https://doi.org/10.1691/ph.2017.7037
41. Olvera-Martínez, B., Cázares-Delgadillo, J., Calderilla-Fajardo, S., Villalobos-García, R., Ganem-Quintanar, A., & Quintanar-Guerrero, D. (2005) Preparation of polymeric nanocapsules containing octyl methoxycinnamate by the emulsification-diffusion technique: Penetration across the stratum corneum. Journal of pharmaceutical sciences, 94(7), 1552–1559. https://doi.org/10.1002/jps.20352
42. Mestres, J.P., Duracher, L., Baux, C., Vian, L., & Marti-Mestres, G. (2010) Benzophenone-3 entrapped in solid lipid microspheres: Formulation and in vitro skin evaluation. International Journal of Pharmaceutics, 400(1–2), 1–7. https://doi.org/10.1016/j.ijpharm.2010.07.028
43. Martins, R., Siqueira, S., Fonseca, M., & Freitas, L. (2014) Skin penetration and photoprotection of topical formulations containing benzophenone-3 solid lipid microparticles prepared by the solvent-free spray-congealing technique. Journal of Microencapsulation, 31(7), 644–653. https://doi.org/10.3109/02652048.2014.911378
44. Marcato, P., Caverzan, J., Rossi-Bergmann, B., Pinto, E., Machado, D., Silva, R., Justo, G., Ferreira, C., & Durán, N. (2011) Nanostructured Polymer and Lipid Carriers for Sunscreen. Biological Effects and Skin Permeation. Journal of Nanoscience and Nanotechnology, 11(3), 1880–1886. https://doi.org/10.1166/jnn.2011.3135
45. Siqueira, N.M., Contri, R.V., Paese, K., Beck, R.C.R., Pohlmann, A.R., & Guterres, S.S. (2011) Innovative Sunscreen Formulation Based on Benzophenone-3-Loaded Chitosan-Coated Polymeric Nanocapsules. Skin Pharmacology and Physiology, 24(3), 166–174. https://doi.org/10.1159/000323273
46. Scalia, S., Mezzena, M., & Ramaccini, D. (2011) Encapsulation of the UV Filters Ethylhexyl Methoxycinnamate and Butyl Methoxydibenzoylmethane in Lipid Microparticles: Effect on in vivo Human Skin Permeation. Skin Pharmacology and Physiology, 24(4), 182–189. https://doi.org/10.1159/000324054
47. Scalia, S., Coppi, G., & Iannuccelli, V. (2011) Microencapsulation of a cyclodextrin complex of the UV filter, butyl methoxydibenzoylmethane: In vivo skin penetration studies. Journal of Pharmaceutical and Biomedical Analysis, 54(2), 345–350. https://doi.org/10.1016/j.jpba.2010.09.018
48. Scalia, S., & Mezzena, M. (2009) Incorporation in Lipid Microparticles of the UVA Filter, Butyl Methoxydibenzoylmethane Combined with the UVB Filter, Octocrylene: Effect on Photostability. American Association of Pharmaceutical Scientists, 10(2), 384–390. https://doi.org/10.1208/s12249-009-9217-2
49. Calderilla-Fajardo, S.B., Cázares-Delgadillo, J., Villalobos-García, R., Quintanar-Guerrero, D., Ganem-Quintanar, A., & Robles, R. (2006) Influence of Sucrose Esters on the In Vivo Percutaneous Penetration of Octyl Methoxycinnamate Formulated in Nanocapsules, Nanoemulsion, and Emulsion. Drug Development and Industrial Pharmacy, 32(1), 107–113. https://doi.org/10.1080/03639040500388540
50. Zhou, Y., Qian, Y., Wang, J., Qiu, X., & Zeng, H. (2020) Bioinspired Lignin-Polydopamine Nanocapsules with Strong Bioadhesion for Long-Acting and High-Performance Natural Sunscreens. Biomacromolecules, 21(8), 3231–3241. https://doi.org/10.1021/acs.biomac.0c00696
51. Godwin, D.A., Kim, N.H., & Felton, L.A. (2002) Influence of Transcutol® CG on the skin accumulation and transdermal permeation of ultraviolet absorbers. European Journal of Pharmaceutics and Biopharmaceutics, 53(1), 23–27. https://doi.org/10.1016/S0939-6411(01)00215-6
52. Brand, R., Spalding, M., & Mueller, C. (2002) Sunscreens Can Increase Dermal Penetration of 2,4-Dichlorophenoxyacetic Acid. Journal of Toxicology. Clinical Toxicology, 40(7), 827–832. https://doi.org/10.1081/clt-120016952
53. Pont, A.R., Charron, A.R., & Brand, R.M. (2004) Active ingredients in sunscreens act as topical penetration enhancers for the herbicide 2,4-dichlorophenoxyacetic acid. Toxicology and Applied Pharmacology, 195(3), 348–354. https://doi.org/10.1016/j.taap.2003.09.021
54. Gu, X., Wang, T., Collins, D.M., Kasichayanula, S., & Burczynski, F.J. (2005) In vitro evaluation of concurrent use of commercially available insect repellent and sunscreen preparations. British Journal of Dermatology, 152(6), 1263–1267. https://doi.org/10.1111/j.1365-2133.2005.06691.x
55. Gu, X., Kasichayanula, S., Fediuk, D.J., & Burczynski, F.J. (2004) In-vitro permeation of the insect repellent N,N-diethyl-m-toluamide (DEET) and the sunscreen oxybenzone. Journal of Pharmacy and Pharmacology, 56(5), 621–628. https://doi.org/10.1211/0022357023402
56. Kasichayanula, S., House, J.D., Wang, T., & Gu, X. (2005) Simultaneous analysis of insect repellent DEET, sunscreen oxybenzone and five relevant metabolites by reversed-phase HPLC with UV detection: Application to an in vivo study in a piglet model. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 822(1–2), 271–277. https://doi.org/10.1016/j.jchromb.2005.06.015
57. Freitas, J.V., Praça, F.S.G., Bentley, M.V.L.B., & Gaspar, L.R. (2015) Trans-resveratrol and beta-carotene from sunscreens penetrate viable skin layers and reduce cutaneous penetration of UV-filters. International Journal of Pharmaceutics, 484(1–2), 131–137. https://doi.org/10.1016/j.ijpharm.2015.02.062
58. Heo, S., Hwang, H.S., Jeong, Y., & Na, K. (2018) Skin protection efficacy from UV irradiation and skin penetration property of polysaccharide-benzophenone conjugates as a sunscreen agent. Carbohydrate Polymers, 195, 534–541. https://doi.org/10.1016/j.carbpol.2018.05.010
59. Rosado, C., Tokunaga, V.K., Sauce, R., Oliveira, C.A., Sarruf, F.D., Parise-Filho, R., Maurício, E., Almeida, T.S., Velasco, M.V.R., & Baby, A.R. (2019) Another Reason for Using Caffeine in Dermocosmetics: Sunscreen Adjuvant. Frontiers in Physiology, 10(519), 1–8. https://doi.org/10.3389/fphys.2019.00519
60. Simeoni, S., Scalia, S., & Benson, H.A.E. (2004) Influence of cyclodextrins on in vitro human skin absorption of the sunscreen, butyl-methoxydibenzoylmethane. International Journal of Pharmaceutics, 280(1–2), 163–171. https://doi.org/10.1016/j.ijpharm.2004.05.021
61. Yang, J., Wiley, C.J., Godwin, D.A., & Felton, L.A. (2008) Influence of hydroxypropyl-beta-cyclodextrin on transdermal penetration and photostability of avobenzone. European Journal of Pharmaceutics and Biopharmaceutics, 69(2), 605–612. https://doi.org/10.1016/j.ejpb.2007.12.015
62. Chen, W.Y., Fang, C.L., Al-Suwayeh, S., Yang, H.H., Li, Y.C., & Fang, J.Y. (2013) Risk assessment of excess drug and sunscreen absorption via skin with ablative fractional laser resurfacing. Lasers in Medical Science, 28(5), 1363–1374. https://doi.org/10.1007/s10103-012-1257-2
63. Li, C.C., Lin, Y.T., Chen, Y.T., Sie, S.F., & Chen-Yang, Y.W. (2015) Improvement in UV protection retention capability and reduction in skin penetration of benzophenone-3 with mesoporous silica as drug carrier by encapsulation. Journal of Photochemistry and Photobiology. B, Biology, 148 [s.n.], 277–283. https://doi.org/10.1016/j.jphotobiol.2015.04.027
64. Andréo-Filho, N., Bim, A.V.K., Kaneko, T.M., Kitice, N.A., Haridass, I.N., Abd, E., Lopes, P.S., Thakur, S.S., Parekh, H.S., Roberts, M.S., Grice, J.E., Benson, H.A.E., & Leite-Silva, V.R. (2018) Development and Evaluation of Lipid Nanoparticles Containing Natural Botanical Oil for Sun Protection: Characterization and in vitro and in vivo Human Skin Permeation and Toxicity. Skin Pharmacology and Physiology, 31(1), 1–9. https://doi.org/10.1159/000481691
65. Mota, A.C.V., Freitas, Z.M.F., Ricci Jr., E., Dellamora-Ortiz, G.M., Santos-Oliveira, R., Ozzetti, R.A., Vergnanini, A.L., Ribeiro, V.L., Silva, R.S., & dos Santos, E.P. (2013) In vivo and in vitro evaluation of octyl methoxycinnamate liposomes. International Journal of Nanomedicine, 8(1), 4689. https://doi.org/10.2147/IJN.S51383
66. Cozzi, A.C., Perugini, P., & Gourion-Arsiquaud, S. (2018) Comparative behavior between sunscreens based on free or encapsulated UV filters in term of skin penetration, retention and photo-stability. European Journal of Pharmaceutical Sciences, 121, 309–318.
67. Daneluti, A.L.M., Neto, F.M., Ruscinc, N., Lopes, I., Velasco, M.V.R., Matos, J.R., Baby, A.R., & Kalia, Y.N. (2019) Using ordered mesoporous silica SBA-15 to limit cutaneous penetration and transdermal permeation of organic UV filters. International Journal of Pharmaceutics, 570, 118633. https://doi.org/10.1016/j.ijpharm.2019.118633
68. Hayden, C.G.J., Cross, S.E., Anderson, C., Saunders, N.A., & Roberts, M.S. (2005) Sunscreen Penetration of Human Skin and Related Keratinocyte Toxicity after Topical Application. Skin Pharmacology and Physiology, 18(4), 170–174. https://doi.org/10.1159/000085861
69. Hung, C.F., Chen, W.Y., Aljuffali, I.A., Shih, H.C., & Fang, J.Y. (2014) The risk of hydroquinone and sunscreen over-absorption via photodamaged skin is not greater in senescent skin as compared to young skin: Nude mouse as an animal model. International Journal of Pharmaceutics, 471(1–2), 135–145. https://doi.org/10.1016/j.ijpharm.2014.05.034
70. Krishnan, R., Pradhan, S., Timares, L., Katiyar, S.K., Elmets, C.A., & Nordlund, T.M. (2006) Fluorescence of Sunscreens Adsorbed to Dielectric Nanospheres: Parallels to Optical Behavior on HaCat Cells and Skin. Photochemistry and Photobiology, 82(6), 1557–1565. https://doi.org/10.1562/2006-02-08-RA-800
71. Roussel, L., Gilbert, E., Salmon, D., Serre, C., Gabard, B., Haftek, M., Maibach, H.I., & Pirot, F. (2015) Measurement, analysis and prediction of topical UV filter bioavailability. International Journal of Pharmaceutics, 478(2), 804–810. https://doi.org/10.1016/j.ijpharm.2014.12.026
72. Sarveiya, V., Risk, S., & Benson, H.A.E. (2004) Skin penetration and systemic absorption of sunscreens after topical application. Journal of the American Academy of Dermatology, 50(3), P75–P75. https://doi.org/10.1016/j.jaad.2003.10.626
73. Tippavajhala, V.K., Mendes, T.O., & Martin, A.A. (2018) In Vivo Human Skin Penetration Study of Sunscreens by Confocal Raman Spectroscopy. American Association of Pharmaceutical Scientists, 19(2), 753–760. https://doi.org/10.1208/s12249-017-0852-8
