| Artigo Original, Biomed Biopharm Res., 2023; 20(2):3-13 doi: 10.19277/bbr.20.2.317; PDF bilingue [+]; html em inglês [EN] |
Efeitos sobre a expressão de genes ligando transmembranar de linfócitos B após tratamento com extrato de Rosa
Mark Christopher Arokiaraj 1 ![]() ✉️ & Eric Menesson 2
✉️ & Eric Menesson 2
1 - Pondicherry Institute of Medical Sciences, Kalapet, Puducherry, India
2 - Tebubio,Le Perray en Yvelines, France
Resumo
Pretendemos avaliar o papel do extrato da rosa vermelha (Pierre de Ronsard) na expressão genética de CD20, CD30, CD40 e CCR5 em linfócitos B humanos.
O extrato foi preparado na diluição de 0,0075% (v/v) e armazenado a -20°C até à sua utilização. O tratamento celular foi efectuado a 37°C. As células foram colocadas em placas de 6 poços a 1,5x106 células por poço e armazenadas a -80°C, extraindo o ARN total. A RTq-PCR foi efectuada de acordo com a Genecopoeia. Utilizámos o método do limiar do ciclo (ΔΔCt) para a análise dos dados. A quantificação comparativa do método Ct (2^-ΔCt ) e a alteração fold para CD20, CD30, CD40 e CCR5 foram - 5,65E+01, 4,80E-01, N/A, 2,47E-01; e 0,954,0,377, N/A e 0,577, respetivamente. A quantidade de ARN total extraída de cerca de 4,5x10⁶ células foi baixa e não permitiu medir o perfil de ARN. Com excepção do CD 40, todos os outros genes foram expressos e bem medidos em ambas as amostras de células B por qRT-PCR. Em conclusão, o tratamento com extrato de rosa diminuiu a expressão dos genes CD30 e CCR5 nos linfócitos B. São necessários mais estudos para aprofundar estes efeitos e o seu potencial.
Palavras-chave: Extrato de rosa, linfócitos B, CD30, CCR5
Como Citar: Arokiaraj, M.C. & Menesson, E. (2023) Effects on expression of B lymphocyte transmembrane ligand genes after treatment with Rose extract. Biomedical and Biopharmaceutical Research, 20(2), 2-13.
Correspondência autor:
Recebido: 18/05/2023; Aceite: 30/09/2023
Introdução
Os linfócitos B são conhecidos pelo seu papel principal na modulação da imunidade. Desempenham um papel importante tanto na imunidade inata como na adaptativa que podem ser modificadas por estas células (1-4). As doenças auto-imunes são moduladas pelas células (2). As células B desempenham um papel na síntese de anticorpos, na apresentação de antigénios, na síntese de citocinas e de quimiocinas (3). Os anticorpos de reação cruzada sintetizados pelas células B ajudam a regular a memória das células B e outras funções imunomoduladoras (4). As células B produtoras de anticorpos do idiotipo 9G4 (9G4+) funcionam como interface entre a imunidade inata e a imunidade adaptativa (1). As terapias de depleção de células B têm sido utilizadas no tratamento de doenças auto-imunes (5). Os ligandos CD20, CD30, CD 40 e CCR5 são expressos na superfície das células B. Estes ligandos são fosfoproteínas da membrana plasmática e têm ligações mais profundas nas células, sendo a sua expressão alterada em várias doenças e condições através de sinais celulares e extracelulares. O CD 20 é expresso numa vasta gama de tumores e na regulação de doenças auto-imunes (6-9). A expressão de CD30 encontra-se nas células de Hodgkin e Reed-Sternberg, nas células do linfoma anaplásico de grandes células e nos linfócitos B ou T activados. Foi demonstrado que o CD30 é um recetor transmembranar significativamente homólogo à família dos receptores do fator de necrose tumoral (TNFR)(11,12). O CD40 é expresso principalmente por células T activadas, bem como por células B activadas e plaquetas; em condições inflamatórias, é também induzido em células monocíticas, células natural killers, mastócitos e basófilos (12-15). O motivo CCRF é multifuncional e intervém na regulação imunitária e na proliferação neointimal (16-17).
Atualmente, existem muitos medicamentos que modulam o efeito destes ligandos em várias doenças (18-25). No entanto, estes medicamentos estão também associados a vários efeitos secundários, o que limita a sua utilização (18-25). Os CD 20, CD 30, CD 40 e CCR5 são os principais ligandos transmembranares associados a algumas doenças importantes. Em estudos anteriores, observámos efeitos imunomoduladores do extrato de rosa através da redução de citocinas pelas células endoteliais (26) aumento de algumas citocinas pelas células T (27) e aumento do CCR5 solúvel e prevenção da redução hipóxica do CXCR4 solúvel das células endoteliais após o tratamento (17). Neste estudo, o extrato de rosa foi utilizado para a avaliação do seu impacto nas células B. A regulação destes ligandos na superfície das células B deverá fornecer mais informações sobre a modulação imunitária do extrato de rosa.
Métodos
A preparação do extrato de rosa é descrita no nosso primeiro estudo (26) . Posteriormente, o extrato foi armazenado a uma temperatura de -20 ºC para nossa utilização. A flor Rosa Rosaceae (Pierre de Ronsard) foi escolhida no jardim do instituto Tebu Bio em Le Perray en Yvelines. Em estudo anterior, mostrámos que o extrato de rosa em concentrações iguais ou inferiores a 0,5% não está associado à lise celular (26).
Seis frascos de células B de células mononucleares periféricas humanas (PBMC) utilizando a seleção imunomagnética positiva diretamente contra CD19 e imediatamente criopreservadas após o isolamento, foram descongeladas, agrupadas e colocadas em 6 poços de uma placa de 6 poços a 1,5x106 células por poço. Após 24 horas, as células de 3 poços foram tratadas durante 24 horas com 0,0075% (v/v) de extrato de rosa preparado durante o projeto POMC-032018. Nos outros três poços, as células B não foram tratadas. Após 24 horas de incubação, as células foram recolhidas como células tratadas e não tratadas, e lavadas duas vezes com PBS. Por fim, foram centrifugadas e armazenadas a -80°C como pellets de células até à extração de ARN. Uma vez que, no estudo anterior a concentração citotóxica nas células endoteliais foi de 0,5% ou superior e os efeitos do tratamento com extrato de rosa foram observados até uma concentração de 0,001%, escolhemos uma concentração de 0,075% (v/v) como uma concentração segura e eficaz para testar as células B neste estudo.
Os materiais utilizados e as referências são - células B do sangue periférico humano (CellApplications, ref. 6904-20a, lote 3342), kit de meio de crescimento de células sanguíneas (Cell Applications, ref. 615K-250), kit NucleoSpin RNA plus (Macherey-Nagel, ref. 740984.10) e BlazeTaq One-Step SYBR Green RT-qPCR Kit (Genecopoeia, ref. QP081). All-in-OneTM qPCR human Primer da Genecopoeia para HPRT1, NM_000194.2 (Ref. HQP009026), UBE2D2, NM_181838.1 (Ref. HQP018366), CD20/MS4A1, NM_152867.2 (Ref. HQP118276), CD30/TNFRSF8, NM_001281430.2 (Ref. HQP059085), CD40/TNFRSF5, NM_001322422.1 (Ref. HQP116918), CCR5, NM_000579.3 (Ref. HQP002210) foram os outros materiais utilizados no estudo.
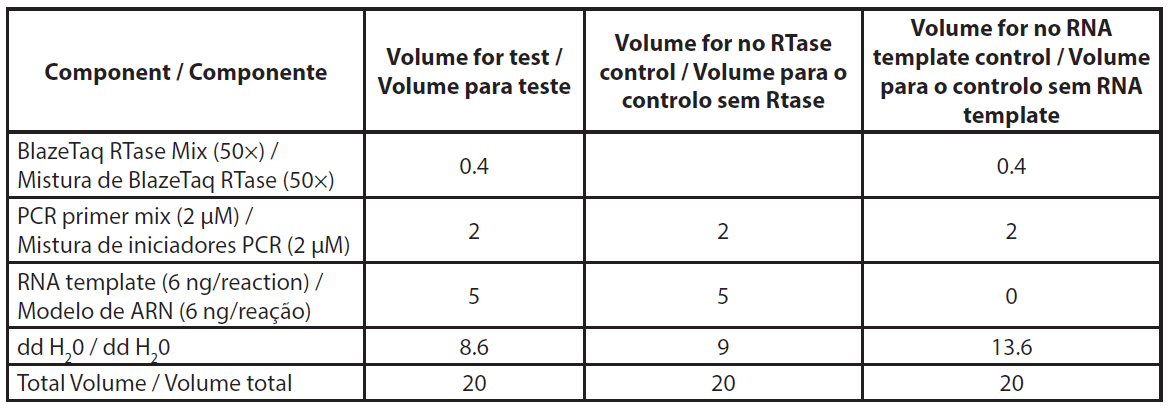
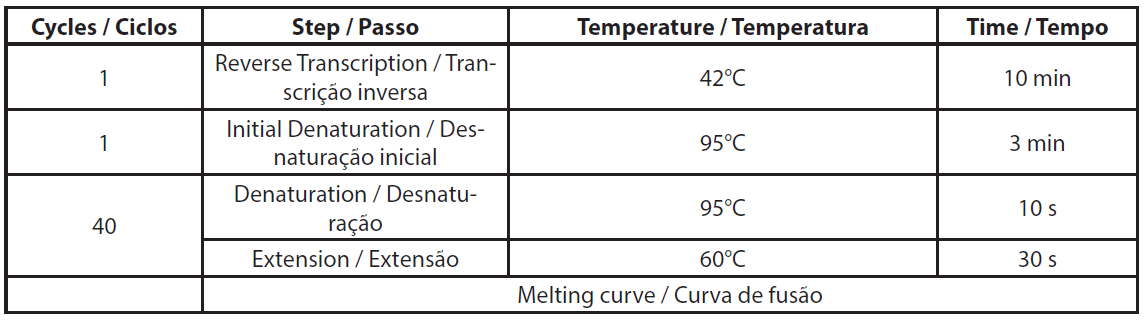
O ARN total foi extraído utilizando o kit NucleoSpin RNA plus (Macherey-Nagel, ref. 740984.10) de acordo com o protocolo do fabricante, incluindo o tratamento com DNase. O ARN extraído foi armazenado a -80°C para o ensaio de qRT-PCR. A qRT-PCR foi efectuada de acordo com as instruções da Genecopoeia. O kit BlazeTaqTM One-Step SYBR® Green RT-qPCR foi concebido para realizar RT e PCR em tempo real num único passo. A qRT-PCR foi efectuada utilizando 6ng de ARN total. Foram efectuados dois controlos por amostra, sem RTase e sem modelo de ARN (NTC). Os volumes necessários para a qRT-PCR são apresentados na Tabela 1. Os componentes da mistura foram distribuídos na placa de PCR. A mistura de primers e o modelo de ARN foram adicionados aos poços correspondentes. A PCR foi efectuada utilizando o Eppendorf Mastercycler RealPlex 2S, seguindo o programa de PCR apresentado na Tabela 2.
| Tabela 1. Descrição da mistura de reação qRT-PCR. |
 |
| Tabela 2. Descrição da programa qRT-PCR. |
 |
Avaliámos o valor delta Ct (∆Ct) para cada amostra subtraindo o valor Ct do gene de referência do valor Ct do gene alvo. Isto dá-lhe a diferença nos níveis de expressão genética entre o gene alvo e o gene de referência em cada amostra. O valor delta Ct médio foi calculado para cada grupo com ou sem tratamento com extrato de rosa. O método delta-delta Ct, também conhecido como o método 2–∆∆Ct , é uma fórmula simples utilizada para calcular a expressão genética relativa (fold) das amostras quando se realiza a reação em cadeia da polimerase em tempo real ou qPCR.
Para a análise dos dados, foi utilizado o método ΔΔCt (limiar do ciclo). Em reacções separadas, o valor Ct foi determinado para cada réplica do gene housekeeping HPRT1 e UBE2D2 (HKG) e do gene de interesse (GOI) em ambas as amostras. Para cada amostra, foi calculada a diferença entre a média de Ct da réplica do GOI e a média de Ct para o HKG (ΔCt). A expressão normalizada do gene GOI foi então determinada como 2(-ΔΔCt).
Os valores do espectro de absorvância foram obtidos pelo NanoVue™ spectrophotometer (GE Healthcare, Piscataway, NJ, EUA).
Resultados
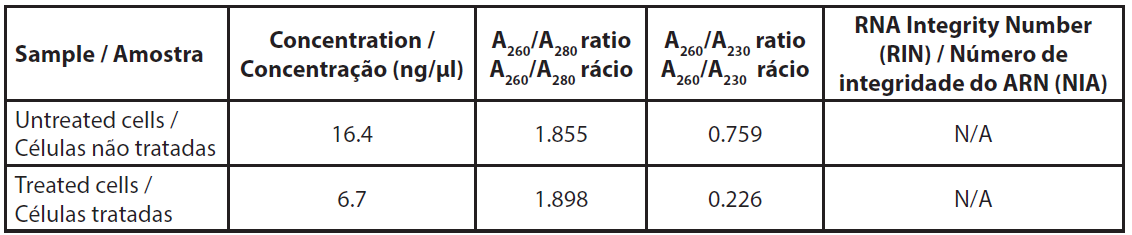
A quantidade de ARN total extraído de cerca de 4,5x106 células foi baixa e não nos permitiu medir o perfil de ARN (Tabela 3). Os rácios A260/A230 eram muito baixos, indicando uma proporção relativamente elevada de sais nas amostras, mas a razão foi a quantidade muito baixa de ARN e não uma quantidade inesperada de sais após a extração.
| Tabela 3. Absorvância dos ARN extraídos. |
 |
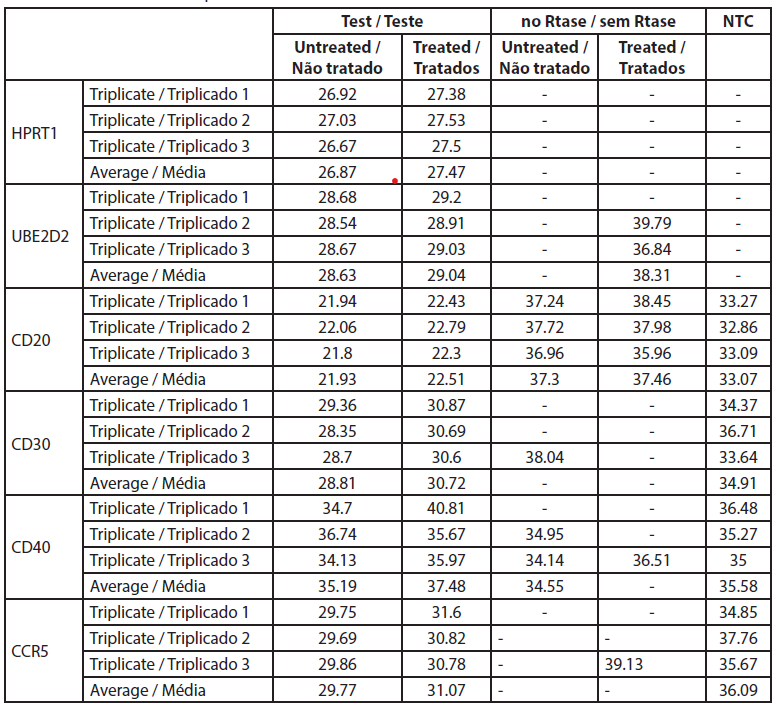
A alteração fold é a expressão genética normalizada na amostra tratada dividida pela expressão genética normalizada nas células não tratadas. Os dados brutos são apresentados na Tabela 4 e as expressões genéticas normalizadas e as alterações fold são apresentadas na Tabela 5.
| Tabela 4. Valores Ct da qRT-PCR. |
 |
| Tabela 5. Alteração da expressão genética entre células B tratadas e não tratadas. |
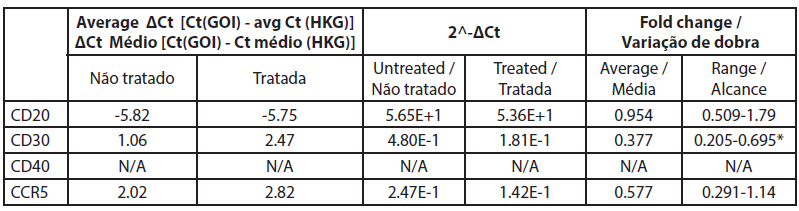 |
A análise da expressão genética por qRT-PCR mostrou que o CD40 não foi expresso em células não tratadas e em células tratadas com extrato de rosa com valores de Ct superiores a 32 (Tabela 5). Neste estudo os níveis de CD20 não foram significativamente alterados pelo tratamento com extrato de rosa. Todos os outros genes foram expressos e bem medidos tanto nas amostras de células B tratadas como nas não tratadas. Os valores de CT dos genes CD20 antes e depois do tratamento com extrato de rosa foram de -5,82 e -5,75, respetivamente, e a alteração média de fold foi de 0,95 (0,51-1,79) (não significativo).
Neste estudo, a expressão de CD30 nas células B é reduzida após o tratamento com extrato de rosa (0,0075%). Reduz para 0,377 vezes em comparação com as células não tratadas, e os resultados são consistentes (0,205 a 0,695). A expressão de CCR5 também é reduzida numa alteração de -0,577 vezes, mas a redução é inconsistente, uma vez que ultrapassa a marca não específica (0,29 a 1,14).
Discussão
Este estudo sugere uma redução da expressão de CD30 após o tratamento com extrato de rosa nos linfócitos B e uma tendência para a redução da expressão do gene CCR5 após o tratamento com extrato de rosa nas células B. Não se verificaram alterações na expressão do gene CD20 após o tratamento com extrato de rosa e o CD40 não foi expresso em células B tratadas ou não tratadas.
Em termos clínicos um beneficio interessante seria a redução da expressão de CD30 nas células cancerosas. O CD30 é um marcador ativo em tumores importantes, como o linfoma de Hodgkins, o linfoma anaplásico de grandes células, o linfoma periférico de células T e o linfoma/leucemia de células T do adulto, bem como em tumores malignos não linfomatosos (28,29). Desempenha igualmente um papel em tumores angiogénic os como os angiossarcomas, o hemangioendotelioma epitelioide, ou o sarcoma de Kaposi (30). Além disso, a inibição do CD30 está associada ao tratamento do linfoma de efusão primária (31). O CD30 é também um marcador ativo em doenças auto-imunes, mas o seu papel neste tratamento não é suficientemente conhecido. O tratamento com CD 30-30L tem sido utilizado no tratamento de doenças auto-imunes e inflamatórias32 . A remissão da artrite reumatoide foi observada no tratamento com o agente anti-CD30, brentuximab vedotin (33). A inibição do CD30 nas células T está também associada à redução da rejeição de enxerto (34) e à glomerulonefrite imunomediade (35). Um estudo experimental associou a inibição da interação CD30-30L com a redução da aterosclerose (36). O CD30 solúvel está reduzido em casos com doença arterial coronária estável (37). A expressão de CD30 está aumentada em doentes com doença pulmonar obstrutiva crónica e na remodelação vascular (38).
A eficácia do extrato de rosa no tratamento da doença da imunodeficiência adquirida através da redução do CCR5 na superfície das células T deve ser estudada em células infectadas com retrovírus. Em estudo anterior, mostrámos os efeitos na redução do CCR5 solúvel em células endoteliais tratadas com extrato de rosa (17). O CCR5 também foi implicado na regulação da sinalização de doenças vasculares, neurológicas e auto-imunes (39) estando envolvido na aprendizagem, na memória e nas funções cognitivas (40).
O extrato de rosa é conhecido pelos seus efeitos anti-inflamatórios, antioxidantes, antidiabéticos e antidepressivos (41,42) atribuindo-se também tem uma certa atividade antibacteriana (41-43) . Em estudos anteriores também detectámos efeitos anti-inflamatórios do extrato de rosa em células T. O presente estudo mostra que até um certo ponto, os efeitos benéficos se devem a uma redução nos níveis de CD30 e CCR5 na superfície das células B.
Reconhecemos algumas limitações no nosso estudo. Foi efectuado in vitro, sendo certo serem necessários estudos de maior dimensão que envolvam um maior número de amostras para avaliar o conceito em in vitro e in vivo. O estudo centrou-se muito nos ligandos específicos da superfície celular. É necessária uma avaliação mais aprofundada das citocinas para obter mais informações sobre a função das células B após o tratamento com extrato de rosa a 0,0075%. As moléculas activas envolvidas no extrato de rosa vermelha devem ser estudadas em pormenor através de análises fitoquímica.
Conclusões
O tratamento com extrato de rosa a 0,0075% (v/v) em linfócitos B não modificou a expressão de CD20. No entanto, a expressão de CD30 e CCR5 parece ter diminuído com o tratamento. O intervalo da alteração do fold mostrou que o resultado da expressão de CD30 era mais exato do que o de CCR5. A redução da expressão de CD30 e CCR5 parece ter potencial para aplicações clínicas que merecem ser estudadas em pormenor em modelos patológicos in vitro e in-vivo.
Financiamento
Nenhum.
Declaração sobre as contribuições dos autores
MCA concebeu a ideia e o método, planeou o estudo, interpretou os resultados e escreveu o artigo. EM preparou o protocolo de métodos, realizou as experimentações e obteve os resultados.
Conflito de Interesses
Os autores declaram que não há relações financeiras e/ou pessoais que possam representar um potencial conflito de interesses.
Referências
1. Milner, E. C., Anolik, J., Cappione, A., & Sanz, I. (2005). Human innate B cells: a link between host defense and autoimmunity?. Springer seminars in immunopathology, 26(4), 433–452. https://doi.org/10.1007/s00281-004-0188-9
2. Tsay, G. J., & Zouali, M. (2018). The Interplay Between Innate-Like B Cells and Other Cell Types in Autoimmunity. Frontiers in immunology, 9, 1064. https://doi.org/10.3389/fimmu.2018.01064
3. Zhang X. (2013). Regulatory functions of innate-like B cells. Cellular & molecular immunology, 10(2), 113–121. https://doi.org/10.1038/cmi.2012.63
4. Grasseau, A., Boudigou, M., Le Pottier, L., Chriti, N., Cornec, D., Pers, J. O., Renaudineau, Y., & Hillion, S. (2020). Innate B Cells: the Archetype of Protective Immune Cells. Clinical reviews in allergy & immunology, 58(1), 92–106. https://doi.org/10.1007/s12016-019-08748-7
5. Lee, D. S. W., Rojas, O. L., & Gommerman, J. L. (2021). B cell depletion therapies in autoimmune disease: advances and mechanistic insights. Nature reviews. Drug discovery, 20(3), 179–199. https://doi.org/10.1038/s41573-020-00092-2
6. Pavlasova, G., & Mraz, M. (2020). The regulation and function of CD20: an "enigma" of B-cell biology and targeted therapy. Haematologica, 105(6), 1494–1506. https://doi.org/10.3324/haematol.
7. Kläsener, K., Jellusova, J., Andrieux, G., Salzer, U., Böhler, C., Steiner, S. N., Albinus, J. B., Cavallari, M., Süß, B., Voll, R. E., Boerries, M., Wollscheid, B., & Reth, M. (2021). CD20 as a gatekeeper of the resting state of human B cells. Proceedings of the National Academy of Sciences of the United States of America, 118(7), e2021342118. https://doi.org/10.1073/pnas.2021342118
8. CD30 [Internet]. Pathology Outlines - PathologyOutlines.com. Available from: https://www.pathologyoutlines.com/topic/cdmarkerscd30.html
9. Michot, J. M., Buet-Elfassy, A., Annereau, M., Lazarovici, J., Danu, A., Sarkozy, C., Chahine, C., Bigenwald, C., Bosq, J., Rossignol, J., Romano-Martin, P., Baldini, C., Ghez, D., Dartigues, P., Massard, C., & Ribrag, V. (2021). Clinical significance of the loss of CD20 antigen on tumor cells in patients with relapsed or refractory follicular lymphoma. Cancer drug resistance (Alhambra, Calif.), 4(3), 710–718. https://doi.org/10.20517/cdr.2020.109
10. de Bruin, P. C., Gruss, H. J., van der Valk, P., Willemze, R., & Meijer, C. J. (1995). CD30 expression in normal and neoplastic lymphoid tissue: biological aspects and clinical implications. Leukemia, 9(10), 1620–1627.
11. van der Weyden, C. A., Pileri, S. A., Feldman, A. L., Whisstock, J., & Prince, H. M. (2017). Understanding CD30 biology and therapeutic targeting: a historical perspective providing insight into future directions. Blood cancer journal, 7(9), e603. https://doi.org/10.1038/bcj.2017.85
12. Funakoshi, S., Longo, D. L., Beckwith, M., Conley, D. K., Tsarfaty, G., Tsarfaty, I., Armitage, R. J., Fanslow, W. C., Spriggs, M. K., & Murphy, W. J. (1994). Inhibition of human B-cell lymphoma growth by CD40 stimulation. Blood, 83(10), 2787–2794.
13. Linderoth, J., Ehinger, M., Jerkeman, M., Bendahl, P. O., Akerman, M., Berglund, M., Enblad, G., Erlanson, M., Roos, G., & Cavallin-Ståhl, E. (2007). CD40 expression identifies a prognostically favourable subgroup of diffuse large B-cell lymphoma. Leukemia & lymphoma, 48(9), 1774–1779. https://doi.org/10.1080/10428190701494520
14. Feng, Z., & Wang, J. (2021). Soluble CD40 ligand inhibits the growth of non-Hodgkin's lymphoma cells through the JNK signaling pathway. Oncology letters, 21(1), 56. https://doi.org/10.3892/ol.2020.12318
15. Karnell, J. L., Rieder, S. A., Ettinger, R., & Kolbeck, R. (2019). Targeting the CD40-CD40L pathway in autoimmune diseases: Humoral immunity and beyond. Advanced drug delivery reviews, 141, 92–103. https://doi.org/10.1016/j.addr.2018.12.005
16. Oppermann M. (2004). Chemokine receptor CCR5: insights into structure, function, and regulation. Cellular signalling, 16(11), 1201–1210. https://doi.org/10.1016/j.cellsig.2004.04.007
17. Arokiaraj, M., & Menesson, E. (2021). Effect of rose extract treatment on soluble CCR5 and CXCR4 secretion by the endothelial cells in vitro.Biomedical Research and Therapy, 8(5), 4333-4344. https://doi.org/10.15419/bmrat.v8i5.672
18. Hansel, T. T., Kropshofer, H., Singer, T., Mitchell, J. A., & George, A. J. (2010). The safety and side effects of monoclonal antibodies. Nature reviews. Drug discovery, 9(4), 325–338. https://doi.org/10.1038/nrd3003
19. Du, F. H., Mills, E. A., & Mao-Draayer, Y. (2017). Next-generation anti-CD20 monoclonal antibodies in autoimmune disease treatment. Auto- immunity highlights, 8(1), 12. https://doi.org/10.1007/s13317-017-0100-y
20. Payandeh, Z., Bahrami, A. A., Hoseinpoor, R., Mortazavi, Y., Rajabibazl, M., Rahimpour, A., Taromchi, A. H., & Khalil, S. (2019). The applications of anti-CD20 antibodies to treat various B cells disorders. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 109, 2415–2426. https://doi.org/10.1016/j.biopha.2018.11.121
21. van Vollenhoven, R. F., Emery, P., Bingham, C. O., 3rd, Keystone, E. C., Fleischmann, R. M., Furst, D. E., Tyson, N., Collinson, N., & Lehane, P. B. (2013). Long-term safety of rituximab in rheumatoid arthritis: 9.5-year follow-up of the global clinical trial programme with a focus on adverse events of interest in RA patients. Annals of the rheumatic diseases, 72(9), 1496–1502. https://doi.org/10.1136/annrheumdis-2012-201956
22. Yi, J. H., Kim, S. J., & Kim, W. S. (2017). Brentuximab vedotin: clinical updates and practical guidance. Blood research, 52(4), 243–253. https://doi.org/10.5045/br.2017.52.4.243
23. Wang, Y., Nowakowski, G. S., Wang, M. L., & Ansell, S. M. (2018). Advances in CD30- and PD-1-targeted therapies for classical Hodgkin lymphoma. Journal of hematology & oncology, 11(1), 57. https://doi.org/10.1186/s13045-018-0601-9
24. Ramos, C. A., Grover, N. S., Beaven, A. W., Lulla, P. D., Wu, M. F., Ivanova, A., Wang, T., Shea, T. C., Rooney, C. M., Dittus, C., Park, S. I., Gee, A. P., Eldridge, P. W., McKay, K. L., Mehta, B., Cheng, C. J., Buchanan, F. B., Grilley, B. J., Morrison, K., Brenner, M. K., … Savoldo, B. (2020). Anti-CD30 CAR-T Cell Therapy in Relapsed and Refractory Hodgkin Lymphoma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 38(32), 3794–3804. https://doi.org/10.1200/JCO.20.01342
25. Muta, H., & Podack, E. R. (2013). CD30: from basic research to cancer therapy. Immunologic research, 57(1-3), 151–158. https://doi.org/10.1007/s12026-013-8464-1
26. Arokiaraj, M. C., & Menesson, E. (2020). Novel anti-inflammatory and immunomodulation effects of rose on the endothelium in normal and hypoxic invitro conditions. Angiologia E Cirurgia Vascular, 15(4), 238–248. https://doi.org/10.48750/acv.221
27. Arokiaraj, M. C., & Menesson, E. (2022). Cytokine Response of CD4+ T-Lymphocytes with Red Rose (Rosa Rosaceae – Pierre de Ronsard) Extracts by in Vitro Evaluation. Galician Medical Journal, 29(1), E202215. https://doi.org/10.21802/gmj.2022.1.5
28. Nakashima, M, & Uchimaru, K. (2023) CD30 Expression and Its Functions during the Disease Progression of Adult T-Cell Leukemia/Lymphoma. International Journal of Molecular Sciences, 24(10):8731. https://doi.org/10.3390/ijms2410873
29. Sharman, J.P., Goldschmidt, J. H., Burke, J. M., Hellerstedt, B. A., McIntyre, K. et al. (2012) CD30 expression in nonlymphomatous malignancies. Journal of Clinical Oncology30:15_suppl, 3069. DOI: 10.1200/jco.2012.30.15_suppl.3069
30. Alimchandani, M., Wang, Z. F., & Miettinen, M. (2014). CD30 expression in malignant vascular tumors and its diagnostic and clinical implications: a study of 146 cases. Applied immunohistochemistry & molecular morphology : AIMM, 22(5), 358–362. https://doi.org/10.1097/PAI.0000000000000048
31. Bhatt, S., Ashlock, B. M., Natkunam, Y., Sujoy, V., Chapman, J. R., Ramos, J. C., Mesri, E. A., & Lossos, I. S. (2013). CD30 targeting with brentuximab vedotin: a novel therapeutic approach to primary effusion lymphoma. Blood, 122(7), 1233–1242. https://doi.org/10.1182/blood-2013-01-481713
32. Oflazoglu, E., Grewal, I. S., & Gerber, H. (2009). Targeting CD30/CD30L in oncology and autoimmune and inflammatory diseases. Advances in experimental medicine and biology, 647, 174–185. https://doi.org/10.1007/978-0-387-89520-8_12
33. Vachhani, P., Bose, N., Brodeur, J. P., Holkova, B., & Bose, P. (2014). Remission of rheumatoid arthritis on brentuximab vedotin. Rheumatology (Oxford, England), 53(12), 2314–2315. https://doi.org/10.1093/rheumatology/keu374
34. Chen, Y. B., McDonough, S., Hasserjian, R., Chen, H., Coughlin, E., Illiano, C., Park, I. S., Jagasia, M., Spitzer, T. R., Cutler, C. S., Soiffer, R. J., & Ritz, J. (2012). Expression of CD30 in patients with acute graft-versus-host disease. Blood, 120(3), 691–696. https://doi.org/10.1182/blood-2012-03-415422
35. Artinger, K., Kirsch, A. H., Mooslechner, A. A., Cooper, D. J., Aringer, I., Schuller, M., Schabhüttl, C., Klötzer, K. A., Schweighofer, K., Eller, P., Yagita, H., Illert, A. L., Rosenkranz, A. R., Lane, P. J., & Eller, K. (2021). Blockade of tumor necrosis factor superfamily members CD30 and OX40 abrogates disease activity in murine immune-mediated glomerulonephritis. Kidney international, 100(2), 336–348. https://doi.org/10.1016/j.kint.2021.02.039
36. Foks, A. C., Bot, I., Frodermann, V., de Jager, S. C., Ter Borg, M., van Santbrink, P. J., Yagita, H., Kuiper, J., & van Puijvelde, G. H. (2012). Interference of the CD30-CD30L pathway reduces atherosclerosis development. Arteriosclerosis, thrombosis, and vascular biology, 32(12), 2862–2868. https://doi.org/10.1161/ATVBAHA.112.300509
37. Mahmoudi, M. J., Hedayat, M., Rezaei, N., Saboor-Yaraghi, A. A., & Mahmoudi, M. (2011). In vitro soluble CD30 levels in patients with chronic stable coronary artery disease. Iranian journal of allergy, asthma, and immunology, 10(4), 237–242.
38. Luo, L., Liu, Y., Chen, D., Chen, F., Lan, H. B., & Xie, C. (2018). CD30 Is Highly Expressed in Chronic Obstructive Pulmonary Disease and Induces the Pulmonary Vascular Remodeling. BioMed research international, 2018, 3261436. https://doi.org/10.1155/2018/3261436
39. Jones, K. L., Maguire, J. J., & Davenport, A. P. (2011). Chemokine receptor CCR5: from AIDS to atherosclerosis. British journal of pharmacology, 162(7), 1453–1469. https://doi.org/10.1111/j.1476-5381.2010.01147.x
40. Necula, D., Riviere-Cazaux, C., Shen, Y., & Zhou, M. (2021). Insight into the roles of CCR5 in learning and memory in normal and disordered states. Brain, behavior, and immunity, 92, 1–9. https://doi.org/10.1016/j.bbi.2020.11.037
41. Mahboubi M. (2015). Rosa damascena as holy ancient herb with novel applications. Journal of traditional and complementary medicine, 6(1), 10–16. https://doi.org/10.1016/j.jtcme.2015.09.005
42. Lee, M. H., Nam, T. G., Lee, I., Shin, E. J., Han, A. R., Lee, P., Lee, S. Y., & Lim, T. G. (2018). Skin anti-inflammatory activity of rose petal extract (Rosa gallica) through reduction of MAPK signaling pathway. Food science & nutrition, 6(8), 2560–2567. https://doi.org/10.1002/fsn3.870
43. Safdar Y., Malik T. (2020) Antibacterial activity of rose extract. Open Access journal of complementary and alternative medicine, 2(4), 194-201. DOI: 10.32474/OAJCAM.2020.02.000144
